| 中山大学孙逸仙纪念医院乳腺肿瘤中心宋尔卫教授主要从事乳腺癌的生物学特性及治疗学基础研究,在非编码RNA调控肿瘤侵袭转移及靶向导入小分子RNA抑制肿瘤转移的研究方面有杰出工作。近期,宋尔卫教授课题组利用RayBio Human Cytokine Antibody Array 揭示了乳腺癌转移的新机制。炎症因子芯片筛查发现,发生EMT的乳腺癌细胞通过分泌细胞因子GM-CSF激活巨噬细胞转化为肿瘤相关巨噬细胞;而肿瘤相关巨噬细胞又可分泌趋化因子CCL18诱导乳腺癌细胞发生EMT和分泌细胞因子GM-CSF,形成正反馈循环环路,在乳腺癌转移中发挥至关重要的作用。该研究成果刊登在国际顶级期刊Cancer Cell(影响因子23.893)。(芯片实验由康成提供技术服务)
研究背景:
乳腺癌是全球女性发病率和死亡率最高的恶性肿瘤,已成为危害女性健康的第一“杀手”。乳腺癌肿瘤转移是导致乳腺癌患者死亡的主要原因,针对乳腺癌肿瘤转移的研究和治疗成为了提高乳腺癌患者生存率的重要课题。上皮-间质转化 (epithelial-mesenchymal transition, EMT) 是乳腺癌肿瘤转移的关键步骤。肿瘤相关巨噬细胞 (tumor-associated macrophages, TAMs)是肿瘤微环境中数目最多的炎症细胞,对肿瘤转移有重要的调控作用。已有的研究发现发生EMT的肿瘤细胞(间充质样肿瘤细胞)和肿瘤相关巨噬细胞都分布在肿瘤侵袭的前沿,提示两者有相互作用。但因为肿瘤微环境在体研究中的困难,该猜想一直停留在假说水平。宋尔卫教授课题组本次研究的目的是利用RayBio Human Cytokine Antibody Array对肿瘤细胞和TAMs的相互作用展开系统研究。
研究思路:
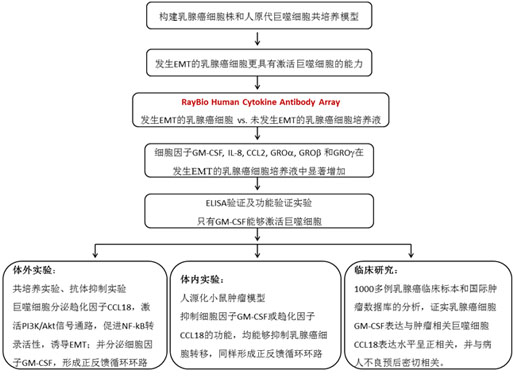
宋尔卫教授课题组通过乳腺癌细胞株和人原代巨噬细胞共培养模型,发现发生EMT的乳腺癌细胞(间充质样肿瘤细胞)比未发生EMT的乳腺癌细胞(上皮样肿瘤细胞)更具有激活巨噬细胞成为TAMs的能力。作者应用RayBio Human Cytokine Antibody Array检测发生EMT和未发生EMT的乳腺癌细胞培养上清液,结果显示GM-CSF ,IL-8,CCL2,GROa,GROb 和GROg 在发生EMT的乳腺癌细胞样本中表达水平显著升高,进一步验证发现只有GM-CSF在乳酸的协同作用下能够激活巨噬细胞转化为TAMs。
宋教授课题组前期实验成果表明TAMs能够促进肿瘤转移。作者用GM-CSF 激活的巨噬细胞处理上皮样肿瘤细胞,能够促使后者转化为间充质样肿瘤细胞。其中,巨噬细胞分泌的趋化因子CCL18在EMT过程中发挥关键作用。研究表明,CCL18通过激活PI3K/Akt信号通路,促进NF-kB转录活性,进而诱导EMT。而转录因子NF-kB的一个靶基因恰是GM-CSF,反过来又能激活肿瘤相关巨噬细胞,从而形成正反馈循环环路。
进一步,宋教授课题组利用人源化小鼠肿瘤模型的研究发现:抑制GM-CSF 能够有效减少CCL18+细胞数目,并且抑制肿瘤转移;而且抑制CCL18能够减少GM-CSF,并且抑制肿瘤转移。这些在体实验证明肿瘤细胞分泌的GM-CSF和TAMs分泌的CCL18可以形成正反馈循环环路,促进乳腺癌肿瘤转移。
此外,作者对中国三个乳腺癌中心1000多例乳腺癌临床标本和国际肿瘤数据库的分析,证实了GM-CSF与CCL18表达水平呈正相关,并与癌细胞EMT表型、高病理恶性程度、三阴乳腺癌亚型和病人不良预后密切相关。
技术路线:
结果展示:
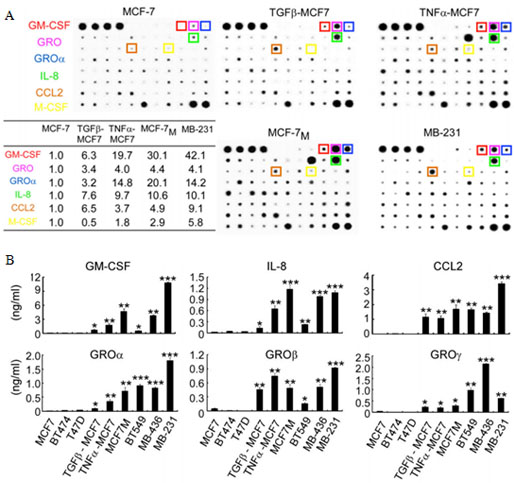
A. RayBio Human Cytokine Antibody Array(炎症因子抗体芯片)检测结果;
B. ELISA验证芯片筛出的差异表达细胞因子;
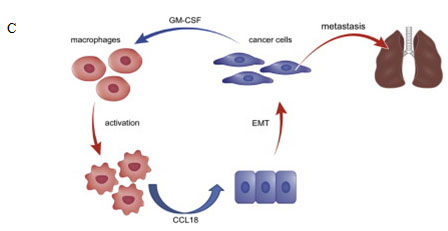
C. 细胞因子GM-CSF和趋化因子CCL18形成正反馈循环环路诱导乳腺癌肿瘤转移模型。
研究意义:
该研究揭示了乳腺癌肿瘤转移的新机制。通过乳腺癌细胞株和人原代巨噬细胞共培养模型,首次揭示发生EMT的乳腺癌细胞比未发生EMT的乳腺癌细胞更具有激活巨噬细胞的能力。炎症因子芯片筛查发现,发生EMT的乳腺癌细胞通过分泌细胞因子GM-CSF,以及大量肿瘤代谢产物乳酸,共同激活巨噬细胞;而巨噬细胞又可分泌趋化因子CCL18激活PI3K/Akt信号通路,促进NF-kB转录活性,诱导乳腺癌细胞发生EMT和分泌细胞因子GM-CSF,形成正反馈循环环路。该研究深入探讨了肿瘤细胞与肿瘤微环境之间的相互关系,为乳腺癌转移机制的深入探索和治疗新靶标的发现提供了重要的新方向。
原文出处:
A Positive Feedback Loop between Mesenchymal-like Cancer Cells and Macrophages Is Essential
to Breast Cancer Metastasis. Cancer Cell, 2014, 25(5): 605-620.
|



