施松涛教授任职于宾夕法尼亚大学,长期从事口腔再生医学及其临床转化方面的研究工作。近期其研究团队利用Arraystar DNA甲基化芯片研究移植间充质干细胞(MSC)通过表观遗传调控Notch信号改善红斑狼疮患者的骨质疏松。这一重要研究发现发布在Cell Metabolism杂志(IF:17.565 )上(DNA甲基化芯片实验由康成生物提供技术服务)。

研究背景
近年来,系统性红斑狼疮患者低骨密度和脆性骨折的发病率逐年增加。目前广泛认为系统性红斑狼疮可以增加骨折的风险,并且大量临床研究发现系统性红斑狼疮患者易发生骨质疏松。而具有自我更新并分化成多种细胞类型能力的骨髓间充质干细胞移植(BSCT)能够有效增加局部骨量,提高骨密度,改善局部骨质疏松情况,纠正骨代谢失衡,减少骨量丢失,增加成骨,为局部骨质疏松的治疗提供了一种新方法。但是对间充质干细胞移植治疗改善骨质疏松的分子机制仍不清楚。DNA甲基化是机体通过表观遗传机制调控基因表达的重要方式,许多研究证明DNA甲基化可以参与多种信号通路,在成骨和骨质疏松发展进程中发挥重要功能。本次研究目的在于探究移植间充质干细胞对于改善系统性红斑狼疮引发的骨质疏松的表观机制,尤其是DNA甲基化的调控作用,为干细胞移植治疗提供理论依据。
研究思路
在本课题中,研究人员采用正常小鼠、MRL/lpr小鼠(系统性红斑狼疮模型)和用骨髓间充质干细胞移植(MSCT)治疗的小鼠作为实验材料,分别采用DNA甲基化芯片和microRNA芯片对3个样本的基因启动子甲基化水平和microRNA表达谱进行分析。发现Notch信号通路相关基因启动子区域在疾病组中呈现低甲基化,相应蛋白水平升高。而疾病组中microRNA29b表达明显上调,结合以往研究背景,研究人员锁定DNMT1为microRNA靶基因。进一步机制研究表明,疾病组中microRNA表达升高是因为缺乏Fas蛋白,Fas缺乏会引起miR-29b无法释放,因而提高了细胞内miR-29b的水平,并会在MRL/lpr BMMSCs中下调DNA甲基转移酶1(Dnmt1)的表达。这会导致Notch1启动子的低甲基化并激活Notch信号通路,转而损害了成骨细胞分化。不仅如此,实验还发现,由MSCT分泌的外泌体,会转移Fas到受体MRL/lpr BMMSCs中,降低细胞内miR-29b的水平,这会恢复Dnmt1介导的Notch1启动子的甲基化,从而改善MRL/lpr BMMSC的功能。
技术路线
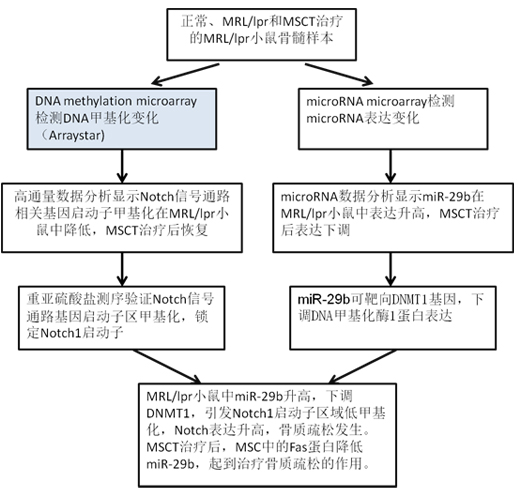
结果展示

图1:左图为正常小鼠MSC成骨分化结果,红色染色区域为形成的新骨;中图为骨质疏松小鼠MSC成骨分化结果,其红色染色区域面积明显低于左图,表明成骨分化能力较弱;右图为骨质疏松小鼠接受正常MSC治疗后,其MSC成骨分化能力已经恢复正常水平,与左图相似。
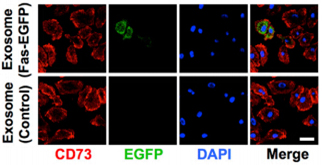
图2:将绿色荧光标记的外泌体静脉注射到疾病小鼠体内24小时后,对小鼠骨髓细胞检测观察,发现外泌体可被疾病小鼠骨髓细胞吸收。红色为细胞膜,绿色为吸收入细胞内的外泌体,蓝色为细胞核。

图3:MA分析DNA甲基化芯片检测结果显示与正常C3H/HeJ小鼠相比,MRL/lpr系统性红斑狼疮疾病组小鼠整体启动子区甲基化下降,经过间充质干细胞移植治疗后,甲基化水平有显著回升。
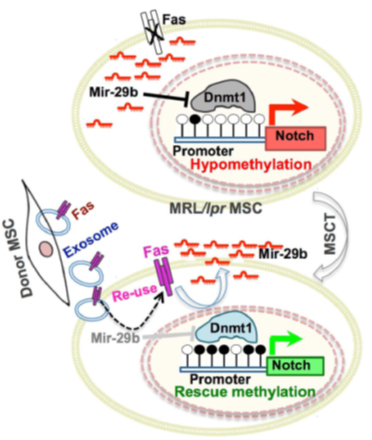
图4:文章机制模式图。MRL/lpr小鼠中miR-29b升高,下调DNMT1,引发Notch1启动子区域低甲基化,Notch表达升高,骨质疏松。MSCT治疗后,MSC分泌的外泌体可携带Fas蛋白进入受体间充质干细胞中。Fas蛋白可降低miR-29b,起到治疗骨质疏松的作用。
作者介绍
施松涛,博士,教授。国际口腔医学界知名科学家、再生医学研究权威,国家教育部长江学者特聘教授,国家杰出青年基金获得者,美国南加州大学奥斯特鲁夫牙科学院教授,美国南加州大学牙科学院颅面分子生物学研究中心教授。长期从事口腔再生医学及其临床转化方面的研究工作,尤其在干细胞基础与应用领域已取得很多开创性的研究成果。
原文出处
Liu SY, et al. (2015) MSC Transplantation Improves Osteopenia via Epigenetic Regulation of Notch Signaling in Lupus. Cell Metabolism. 22, 1-13.

|