
|
||||
 |
||||
| DNA Extractor® Kit 说明书 No.295-50201 本产品是血清中含有的病毒DNA 和生物制品宿主细胞残余DNA 的提取试剂盒, 无有毒溶剂、 提取时间短、DNA 提取纯度高、DNA 回收率高。 ■ DNA 抽提原理 高浓度的促溶剂碘化钠和阴离子去垢剂参与生物制品中蛋白质和脂质的溶解,然后在混合物中加入异丙醇,糖原和核酸共沉淀可作为载体,而碘化钠和阴离子去垢剂阻止样品中蛋白等成分的沉淀使其溶于液相,从而选择性沉淀DNA。 ■ 试剂
■ 保存 2 - 10℃,试剂盒的保存期为2 - 3 年。 |
||||
---------------------------------------------------------------------------------------------------------------------------------- |
||||
DNA Extractor® Kit 实验方案 * 为Molecμlar Devices 公司注册商标,是使用生物传感器的高灵敏度分析装置。 参考文献1. Ishizawa, M., Kobayashi, Y., Miyamura, T. and Matuura,: Simple Procedure of DNA isolation from human seru Nucleic Acids Res., 19, 5792 (1991) DNA Extractor® Kit 问题集 Q1:产品的特色是什么? A1:传统的方式是采用蛋白酶-SDS 的方法提取DNA,虽然能够获得高品质的DNA,但是后续需要用苯酚- 氯仿进行处理,而苯酚- 氯仿属于危险化学品,对人体有一定危害。Wako 的该试剂盒采用碘化钠法,能获得高质量和高回收率的DNA,抽提过程不需要使用苯酚-氯仿。碘化钠代替苯酚- 氯仿,溶解蛋白和脂类。糖原作为载体,异丙醇沉淀DNA。只需将试剂加入离心管内即可,不同于其他的DNA 抽提试剂盒采用柱吸附法。 Q2:测定原理 A2:碘化钠是离液序列离子的代表化合物,可作为蛋白质的溶解剂使用。月桂基酰基氨酸钠是和SDS 相同的表面活性剂,蛋白质的改性剂。由这两个化合物作用使蛋白质改性后与核酸分离。蛋白质的改性、溶解(核酸也是溶解状态)的状态中添加酒精(异丙醇),使核酸析出,沉淀。 Q3:产品说明书中的方法1 是血清中提取DNA,请问血浆是否可用? A3:血浆可以用。 Q4:产品回收率多少? A4:一般,样品中提取残留DNA,即使极微量(DNA 在10 pg 左右)也能高效率的回收而不伤害样品。文献* 报道的回收率是80% ~ 90% Q5:该产品说明书上提供了两种方法,该如何选择? A5:方法 1 是用于血清DNA 的抽提,如果样品蛋白浓度高可以采用这种方法。 方法 2 是Threshold Systems 总DNA 检测时样品的处理,是配套Molecμlar Devices 的生物制品中定量DNA 和蛋白的光寻导电位传感器(LAPS)使用。在其说明书上有介绍Wako 该款试剂盒的操作步骤。如果样品蛋白浓度低,也可以采用方法2。Molecμlar Devices 说明书上的步骤,和Wako 该款试剂盒的操作步骤略有差异,客户可依据具体情况而定。 Q6:什么样的样品可使用该款试剂盒? A6:检测生物蛋白类药物包括抗体,疫苗和治疗性蛋白中残留的DNA。这些生物制药可能是由细菌,酵母,动物或者细胞系生产获得。残留的宿主细胞DNA 即使是小剂量,也会引起药物安全性问题,所以FDA 和WHO 对生物蛋白类药物中残留的宿主DNA 都有规定。 Q7:是否可以用蛋白酶K(Proteinase K)裂解细胞? A7:推荐用蛋白酶K 先处理样品,可提高回收率。Protein K 本身不含有DNA。 Q8:客户使用该试剂盒前用蛋白酶K 消化样品蛋白,但是回收率没有达到文献* 提到80 ~ 90%。 A8:蛋白酶K 消化蛋白灭活核酸酶的过程可能导致纯化过程中DNA 降解。建议37 ℃(或60 ℃过夜),添加SDS 裂解缓冲液。(MD 的操作是加入蛋白酶K 和SDS 溶液,55℃过夜) 注意:PK 处理的后期SDS 浓度不能超过0.1%。在处理的末期,SDS 可能减少1/10。裂解缓冲液开始不能超过1% SDS。 Q9:是否可以用乙醇替代异丙醇? A9:用乙醇替代异丙醇,可能会导致回收率下降。若要使用乙醇,客户可尝试自己优化条件。 Q10:按照方法2,样品的体积是400 μl 或者500 μl,如果添加蛋白酶K,样品的体积应该是多少? A10:添加蛋白酶K 以及缓冲液的,包括蛋白酶K 和缓冲液在内样品的体积是400 μl 或者500 μl。 |
||||
| ----------------------------------------------------------------------------------------------------------------------------------- | ||||
Wako DNA 提取试剂盒产品选择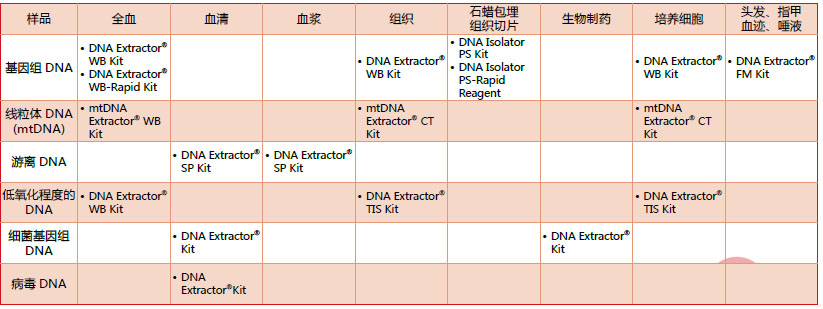 DNA Extractor® 系列产品列表
|
 |
www.boppard.cn 北京 Tel:010-85804838 广州 Tel:020-87326381 |
info@ boppard.cn 上海Tel:021-62884751 香港Tel:852-27999019 |




