
轻松实现准确CRISPR基因敲入的奥秘
大家都知道,CRISPR/Cas9基因编辑技术在高效获得基因敲除突变(knockout)方面是非常有效的,但是想要通过同源重组修复途径(HDR)敲入>200 bp的长基因片段或者序列的话,是很难成功实现的。基因敲入(knockin)实验所面临的主要挑战之一就是供体模板的制备。
双链DNA(dsDNA)和单链DNA(ssDNA)都可以作为HDR修复机制的供体模板。不过,质粒或者PCR片段这样的dsDNA供体模板存在随机整合到基因组上的风险,在准确的基因编辑上的应用是非常有限的。而ssDNA随机整合的风险则大大降低,主要插入Cas9/sgRNA复合物所靶定的位点(Chen et al. 2011; 图1)。与此同时,由于未整合的模板不能正常表达,这样可以更容易地识别并筛选出目的细胞克隆。此外,通过电穿孔方法导入时,ssDNA供体模板对细胞的毒性也要远低于dsDNA模板。
为了验证ssDNA作为供体模板的效果以及是否会发生随机整合反应,Takara科学家分别以dsDNA和ssDNA作为HDR供体模板,使用绿色荧光蛋白质AcGFP1去标记HEK293细胞中的GAPDH基因。所设计的HDR供体模板的同源臂序列为GAPDH外显子8的末端序列,AcGFP1与GAPDH处于同一阅读框(图A)。之后,通过流式细胞术比较分析以dsDNA和ssDNA分别作为供体模板的实验结果(图B)。
结果显示,当以dsDNA作为供体模板时,即使没有Cas9 RNPs,仍然出现相当多的带有绿色荧光的细胞克隆。而当以长ssDNA正义链或者反义链作为修复模板时,只有同时加入Cas9和sgRNA,才会发生整合反应。如此看来,ssDNA随机整合的风险的确大大降低了。
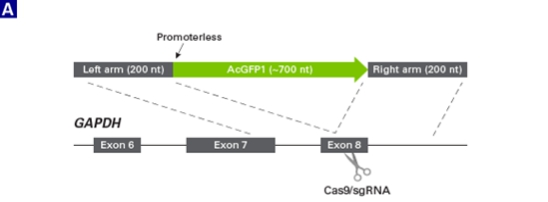
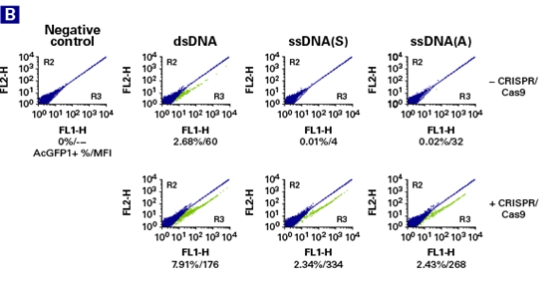
图1. 在HEK293细胞的GAPDH的C-末端定点敲入AcGFP1基因。
此外,Takara科学家还比较了在knockin实验中导入dsDNA和ssDNA所产生的细胞毒性。分别以dsDNA和ssDNA作为HDR供体模板,使用绿色荧光蛋白质AcGFP1去标记Cellartis hiPSC18细胞中的tubulin基因。结果显示,无论加入Cas9与否,dsDNA的导入都会引起显著的细胞毒性;而以ssDNA作为供体模板时,则观察不到明显的细胞毒性反应。

图2. 比较knockin实验中导入dsDNA和ssDNA所产生的细胞毒性(细胞系为Cellartis hiPSC18)
ssDNA作为CRISPR基因敲入供体模板,由于其非特异性整合概率低、细胞毒性低的特性可以轻松实现准确CRISPR基因敲入,让我们获得更为可信的基因编辑结果。然而,一旦ssDNA长度超过了200 bp的话,其合成费用就变得非常昂贵,也容易出错。而Takara旗下的Clontech品牌推出的Guide-it™ Long ssDNA Production System,可制备长达5 kb的单链DNA寡核苷酸,经济、简便、错误率低,是基因敲入研究科学家们的智慧之选。
详情请点击: |
 |
