
电泳基础知识介绍
电泳是生物学研究经常使用的技术手段之一。
Takara电泳产品线提供多种产品选择和令人放心的产品质量。从各种电泳仪器,电泳仪器配件,到电泳试剂耗材,再到耐心的实验问题解答,Takara就是您可以信赖的电泳实验助手。
一、原理:
电泳是分离、纯化和鉴定核酸的一种常用方法,目前实验室中常用到的是琼脂糖凝胶电泳,其利用琼脂的主要成分琼脂糖(Agarose) 作支持介质进行电泳,适合分离、纯化200 bp-50 kb长度的核酸片段,且可高纯度、高效地从凝胶中回收分离的核酸。
其分析原理与其他支持物电泳最主要区别是,它兼有“分子筛”和“电泳”的双重作用。
琼脂糖凝胶具有类似网络的结构,当DNA在网状结构中移动时,大的DNA被网状物捕获,移动速度慢,小的DNA不容易被网状物捕获,移动速度快,利用这一性质,可以根据长度分离出DNA。此外,DNA在水溶液中带负电荷,所以在电场中会向正极移动。

二、流程


■ 电泳用buffer作用
电泳用buffer是一种具有缓冲能力的离子溶液,它的主要作用是:
①在电泳过程中,维持溶液的pH稳定。
②使溶液具有一定的导电性,以利于DNA分子的迁移。
■
电泳用buffer优缺点
实验室中常见的核酸电泳缓冲液主要是TAE(Tris-Acetate-EDTA)和TBE(Tris-Borate-EDTA)这两种,两者的区别是:
| 电泳用buffer |
优点 |
缺点 |
| TAE |
- 可更好地分离大片段
- 超螺旋在其中电泳时更符合实际相对分子质量
- 双链线状DNA在其中的迁移率较TBE快约10%
|
- 缓冲能力低;更适用于短时间运行
- 更容易导致凝胶过热
|
| TBE |
- 对于较小片段的分离效果更好
- 缓冲能力强;适用于长时间运行
- 不易导致凝胶过热
|
- 电泳显示的相对分子质量会大于实际分子质量
- 不宜在回收DNA片段的电泳中使用
|
■ 电泳用buffer制备
实验室经常会将TAE或TBE配制成高浓度的储备液,实验前稀释储备液到1×的工作液。配制方法虽然不算难,但是需要前期采购原料、适当保存、称量、溶解、调整pH等,配制过程比较繁琐、枯燥,并且耗时较长。
这里向大家强烈推荐Takara的电泳缓冲液方便装,采用干粉的形式,方便运输及储存,使用时无需称量试剂,只需将每包产品加入定量的水或去离子水溶解,即可简便、快速的制备1L的TAE或TBE电泳缓冲液。
此外,Takara还提供其他用于一般分子生物学实验的常用缓冲液方便装,详见下表:


■ 琼脂糖凝胶制备方法及注意事项:
① 配制缓冲液:配制适量的电泳及制胶用的缓冲液(通常是 0.5×TBE 或 1×TAE)。
② 加入胶粉:根椐制胶量及凝胶浓度,在加有一定量的电泳缓冲液的三角锥瓶或平底烧瓶中,加入准确称量的琼脂糖粉(总液体量不宜超过锥瓶或烧瓶的 50%容量)。 
注意事项:用于电泳的缓冲液和用于制胶的缓冲液必须统一。
③ 溶胶:在锥瓶或烧瓶的瓶口上盖上保鲜膜,并在膜上扎些小孔,然后在微波炉中加热溶解琼脂糖。加热时,当溶液沸腾后,请戴上防热手套,小心摇动锥瓶或烧瓶,使琼脂糖充分均匀溶解。此操作重复数次,直至琼脂糖完全溶解。
注意事项:在微波炉中加热时间不宜过长,每次当溶液起泡沸腾时停止加热,否则会引起溶液过热暴沸,造成琼脂糖凝胶浓度不准,也会损坏微波炉。溶解琼脂糖时,必须保证琼脂糖充分完全溶解,否则,会造成电泳图像模糊不清。 
④ 加入溴化乙锭:使溶液冷却至60℃左右,如需要可在此时加入溴化乙锭溶液(终浓度 0.5 μg/ml),并充分混匀。
注意事项:溴化乙锭是一种致癌物质。使用含有溴化乙锭的溶液时,请戴手套。
⑤ 倒胶:将琼脂糖溶液倒入制胶模中,然后在适当位置处插上梳子。凝胶厚度一般在 3-5 mm 之间。
⑥ 凝胶:在室温下使胶凝固(大约 30 分钟-1 小时),然后放置于电泳槽中进行电泳。
注意事项:凝胶不立即使用时,请用保鲜膜将凝胶包好后在4℃下保存,一般可保存2-5天。
■ 琼脂糖的选择:
琼脂糖(Agarose)凝胶电泳是检定、分离DNA片段的重要手段,进行琼脂糖凝胶电泳时,琼脂糖的纯度会直接影响DNA的分辨能力及电泳结果的清晰度。如琼脂糖中混有其他糖、盐及蛋白质,会影响DNA在凝胶中的迁移速度以及回收后的DNA片段进行酶促反应时的反应性能。因此,使用高质量的琼脂糖对实验的成功非常重要。
推荐Takara的Agarose Regular(Code No. 5260),适合于制作0.5~2%的琼脂糖凝胶,物理性质如下:


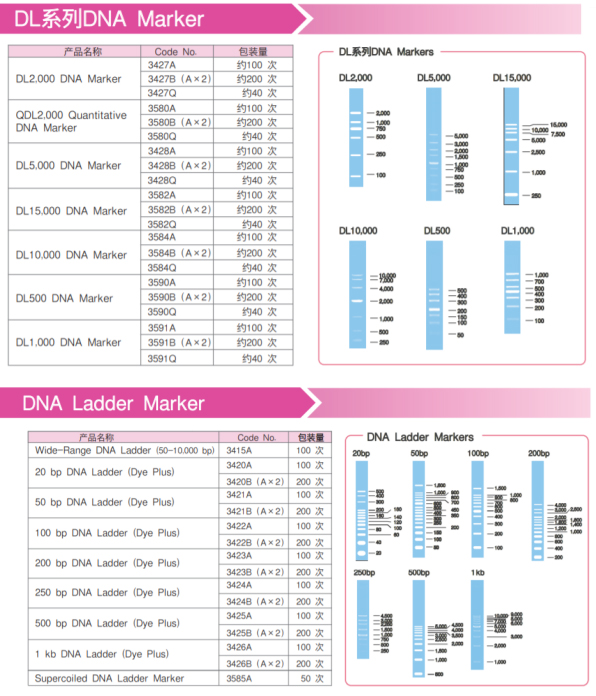
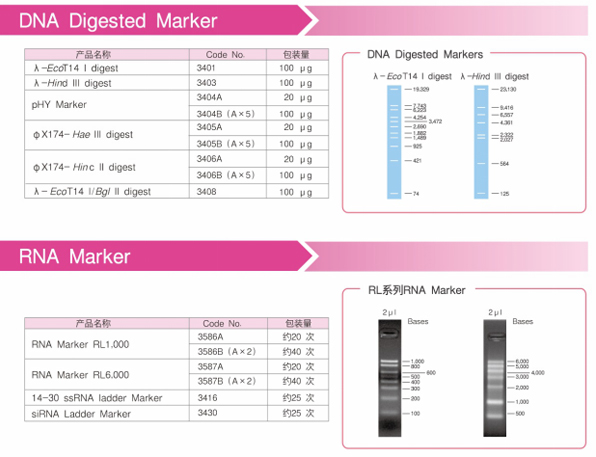
在进行琼脂糖凝胶电泳时,Marker作为一种参照,可以用来对比和确定目的条带的大小。
Takara品牌的Marker出身名门,有着大品牌的品质;经典的产品,却有着亲民的价格,是您的明智之选!

■ 电泳&染色流程图:

■ 电泳详细操作步骤:
① 装胶:将上一步骤制备好的琼脂糖凝胶放置在电泳槽中,将缓冲液填充到凝胶完全浸泡的程度。
② 安装电极:因为DNA是朝着正极流动的,所以正极和负极的方向不要弄错。
③ 上样:PCR反应液和loading Buffer混合后,上样到胶孔中。
④ 电泳:按下电源,开始进行电泳。
推荐Takara的Mupid-One(Code No. AD160),仪器特点如下:
 
⑤ 凝胶成像:如果是前染色(制胶过程中已加入染料)的话,电泳结束后,可直接将电泳胶放入凝胶成像仪中,拍照分析。
如果选择电泳后染色,只要找一个大的培养皿之类的容器,加入EB等染料的稀释液,放入凝胶后缓慢振荡15分钟左右即可,两者的区别是:
之后放入凝胶成像仪中,拍照分析。
⑥ 扩增产物确认:对电泳后凝胶成像的照片进行分析、确认。


PCR产物经电泳后,常常需要对一些DNA电泳片段进行回收和纯化,用于后续连接反应、PCR扩增、DNA测序等。

|
