C-NKG

即日起至2023年10月31日,参与「开学优惠GO」,畅享双重福利
- 福利一:订购重度免疫缺陷鼠C-NKG,可享买二送二。下拉查看C-NKG小鼠详情及验证数据
- 福利二:订购皮下成瘤CDX小鼠模型,仅需499元/只,可选受体品系为:C-NKG、NOD-Scid、BALB/c nude,另有精美礼品赠送。点击查看CDX小鼠详情及验证数据
简介
C-NKG小鼠是赛业生物在NOD-Scid背景品系上敲除Il2rg基因自主研发的一种重度免疫缺陷小鼠。C-NKG小鼠缺乏成熟的T、B、NK免疫细胞,补体活性降低,巨噬细胞对人源细胞吞噬作用弱,可高效地移植人造血干细胞(HSC)、外周血单核细胞(PBMC),患者来源的异种移植物(PDX)或成体干细胞和组织,是目前公认的免疫缺陷程度高且可用于肿瘤、免疫、自身免疫性疾病、免疫治疗疫苗、GvHD/移植、安全性评估等研究的优秀模型。
- 产品编号:C001316
- 品系名称:NOD-Prkdcscid Il2rgem1/Cyagen
- 基因型:纯合子
- 背景:NOD-Scid
品系特点
- 缺乏成熟的T、B和NK细胞。
- 补体活性降低。
- 巨噬细胞和树突状细胞功能异常。
- 随着年龄的增长,T和B细胞泄漏的发生率极低。
- 淋巴瘤的发生率极低,可用于长期和短期实验。
- 不发展糖尿病。
研究应用
- 与NOD-Scid小鼠相比,C-NKG小鼠的人体细胞和组织移植存活率显著提高,同时能够植入更高比例的正常或癌变人类细胞和组织。
- 可高效地移植人造血干细胞(HSC)、外周血单核细胞(PBMC),患者来源的异种移植物(PDX)或成体干细胞和组织。
- 可用于肿瘤、免疫、自身免疫性疾病、免疫治疗疫苗、GvHD /移植、安全性评估等研究。
模型验证
- C-NKG小鼠外周血中B、T和NK细胞的检测
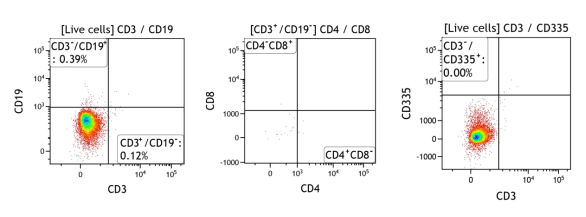
图1. C-NKG小鼠外周血中的B、T和NK细胞严重缺失,表现为重度免疫缺陷。取C-NKG小鼠的外周血,对其T、B和NK细胞的组成进行代表性流式细胞免疫表型分析及统计对比。检测结果显示C-NKG小鼠外周血中的B细胞(CD3-CD19+)、T细胞(CD3+CD19-)、辅助性T细胞(CD3+CD4+CD8-)、细胞毒性T细胞(CD3+CD4-CD8+)、NK细胞(CD335+CD3-)几乎完全缺失。
- C-NKG小鼠脾脏组织中B、T和NK细胞的检测
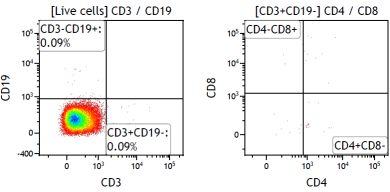
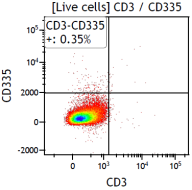
图2. C-NKG小鼠脾脏组织中的B、T、NK细胞严重缺失,表现为重度免疫缺陷。取C-NKG小鼠的脾脏组织,对其T、B和NK细胞的组成进行代表性流式细胞免疫表型分析及统计对比。检测结果显示C-NKG小鼠脾脏组织中的B细胞(CD3-CD19+)、T细胞(CD3+CD19-)、辅助性T细胞(CD3+CD4+CD8-)、细胞毒性T细胞(CD3+CD4-CD8+)、NK细胞(CD335+CD3-)几乎完全缺失。
- C-NKG小鼠用于huPBMC免疫系统重建研究
- 生存曲线
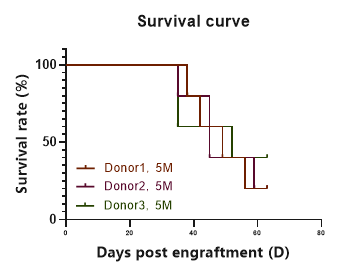
图3. huPBMC-C-NKG小鼠生存曲线。在移植后35天左右,huPBMC-C-NKG小鼠随着移植物抗宿主病(GvHD)的出现而逐渐开始死亡,移植60天后仍有约20%小鼠存活。
- 人源白细胞重建比例
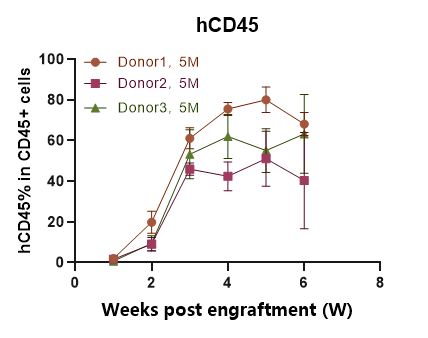
图4. 移植人源PBMC后C-NKG小鼠外周血中人源CD45+细胞的含量变化。移植人源PBMC后C-NKG小鼠外周血中人源白细胞的含量逐渐增加,3周后人源CD45+细胞的比例均值超过40%,重建速度较快(同类产品一般4周才可达到同等水平人源化比例),在移植后3-6周人源化比例持续处于较高水平。
- 人源T细胞重建比例
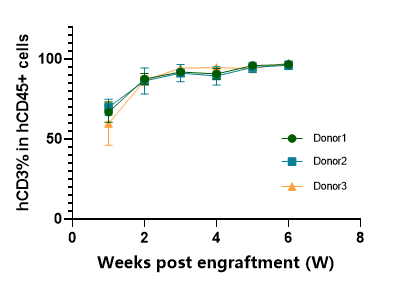
图5. 移植人源PBMC后C-NKG小鼠外周血中人源CD3+T细胞的含量变化。在人源PBMC移植3周后,C-NKG小鼠体内约95%-100%的hCD45+细胞为hCD3+T细胞,表明huPBMC-C-NKG小鼠人源免疫系统重建以T细胞为主。
- GvHD反应
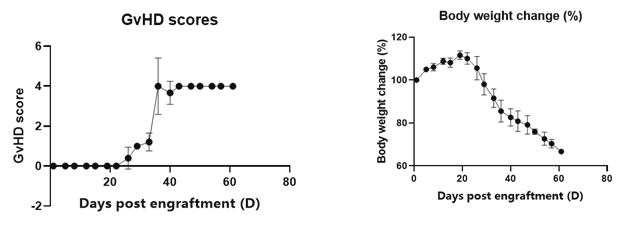
图6. 人源PBMC移植C-NKG小鼠后GvHD评分及小鼠体重变化。人源PBMC移植至C-NKG小鼠后,在28天左右开始出现GvHD现象,小鼠体重明显下降,45天后体重降低超过20%。
- 利用huPBMC-C-NKG模型进行抗GvHD药效评价
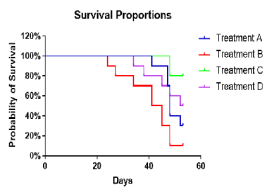
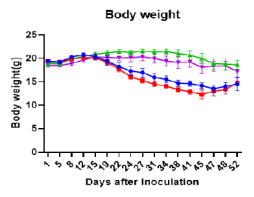
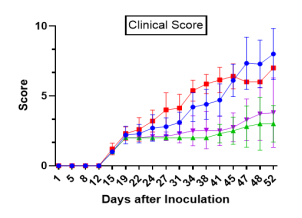

图7. 利用huPBMC-C-NKG模型进行抗GvHD药效评价。huPBMC-C-NKG小鼠可用于GvHD药物评价以及靶点在T细胞的肿瘤免疫治疗(双特异性抗体、免疫检查点抑制剂)研究。(Treatment A、Treatment B、Treatment C和Treatment D均指不同的抗GvHD药物处理,药物来自第三方客户)
- 基于血液瘤AML模型的mRNA疫苗药效学评估
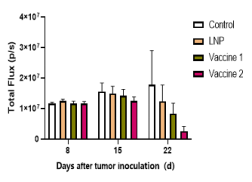
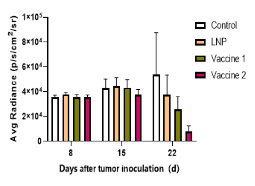
图8. 基于血液瘤AML模型的mRNA疫苗药效学评估。人源PBMC移植至C-NKG小鼠后,进行血液瘤AML荷瘤实验,并用mRNA疫苗抑制肿瘤的生长。结果显示,mRNA疫苗对血液瘤具有明显的抑制作用。
- C-NKG成体鼠(Adult)用于huCD34+ HSC免疫系统重建研究
- 生存曲线
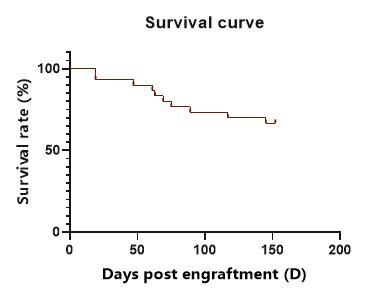
图9. huHSC-C-NKG成体移植鼠小鼠生存曲线。huHSC-C-NKG成体移植鼠不存在移植物抗宿主病(GvHD),在移植150天后仍保持70%以上的存活率。
- 生长曲线
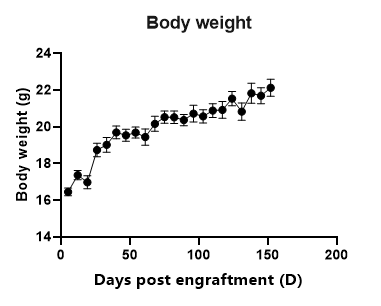
图10. huHSC-C-NKG成体移植鼠生长曲线。huHSC-C-NKG成体移植鼠在移植人源HSC后能维持正常的生长。
- 人源白细胞重建比例
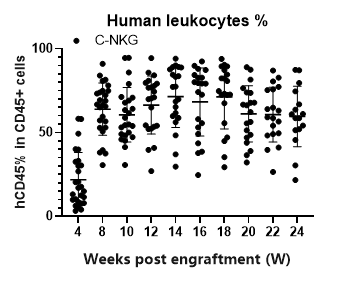
图11. 移植人源HSC后C-NKG成体小鼠外周血中人源CD45+白细胞(leukocytes)的含量变化。移植人源HSC后C-NKG成体小鼠外周血中人源白细胞的含量逐渐增加,重建稳定后人源CD45+白细胞的平均比例可达60%以上。
- 人源T细胞和B细胞的重建
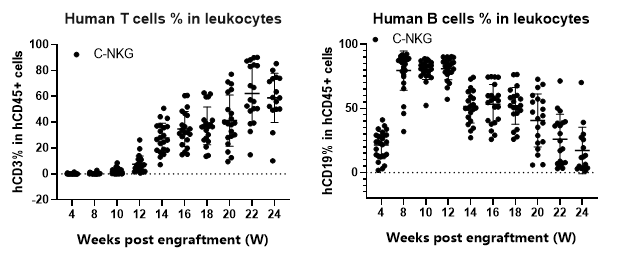
图12. 移植人源HSC后C-NKG成体小鼠人源T细胞和B细胞的重建效果。该模型早期的免疫系统重建以B细胞为主,后期B细胞比例逐渐下降,T细胞比例逐渐上升。在人源HSC移植12周开始,C-NKG小鼠体内T细胞比例开始增加,在16周时就可达40%左右;B细胞的比例在移植初期较高,可达80%,随着移植的时间增加,B细胞的比例不断下降,在第24周时降至15%左右。
- 人源NK细胞和单核细胞的重建
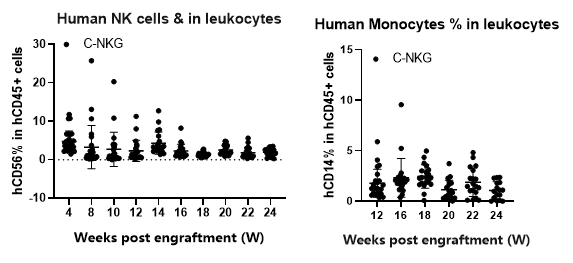
图13. 移植人源HSC后C-NKG成体小鼠中人源NK细胞和单核细胞的重建效果。该模型免疫系统重建过程中NK细胞和单核细胞的重建比例较低,NK细胞平均重建比例总体维持在2%左右,单核细胞在移植第16周的重建比例为2%左右。
- C-NKG新生鼠(Newborn)用于huCD34+ HSC免疫系统重建研究
- 生存曲线
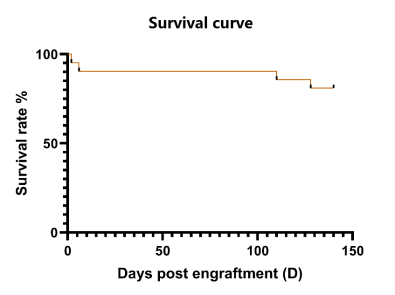
图14. huHSC-C-NKG新生鼠移植生存曲线。huHSC-C-NKG新生鼠不存在移植物抗宿主病(GvHD),在移植100天前可保持90%以上存活率,移植近150天存活率仍能保持在80%以上,生存率高于成体鼠重建模型。
- 生长曲线
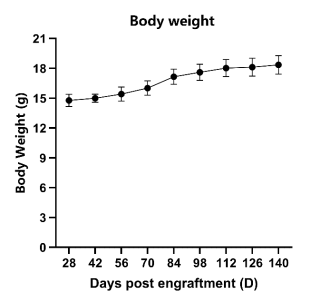
图15. huHSC-C-NKG新生鼠移植生长曲线。huHSC-C-NKG新生鼠在移植人源HSC后能维持正常的生长。
- 人源白细胞重建比例
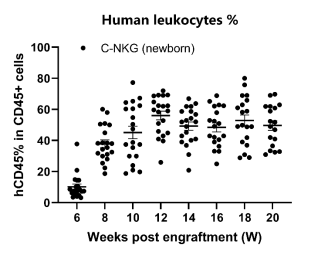
图16. 移植人源HSC后C-NKG新生小鼠外周血中人源CD45+白细胞(leukocytes)的含量变化。移植人源HSC后C-NKG小鼠外周血中人源白细胞的含量逐渐增加,移植8周后人源CD45+白细胞的平均比例就可达40%以上,后续上升并维持在60%左右。
- 人源T细胞和B细胞的重建
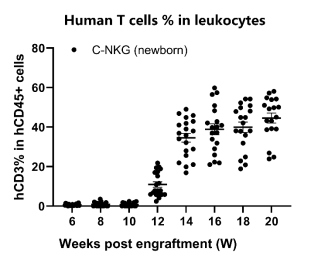
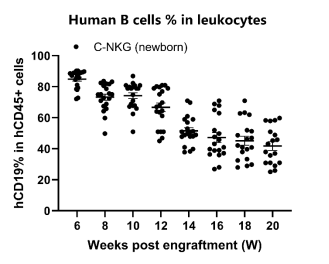
图17. 移植人源HSC后C-NKG新生小鼠人源T细胞和B细胞的重建效果。与成体鼠重建模型相似,该模型早期免疫系统的重建以B细胞为主,后期B细胞比例逐渐下降,T细胞比例逐渐上升。在人源HSC移植第12周开始,C-NKG新生鼠体内T细胞比例开始增加,在14周时就达40%左右;B细胞的比例在移植初期高于80%,随着移植的时间增加,B细胞的比例不断下降,在第20周时降为40%。
- 人源NK细胞和单核细胞的重建
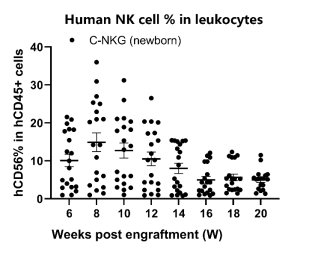
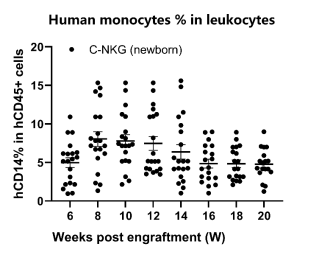
图18. 移植人源HSC后C-NKG新生小鼠中人源NK细胞和单核细胞的重建效果。该新生小鼠重建模型中NK细胞和单核细胞的重建比例较成体鼠模型高,NK细胞的平均重建比例在早期可达10%以上,后期维持在5%左右,单核细胞的平均重建比例也高于5%,因此新生鼠重建模型更适合于与髓系细胞靶点相关的研究。
- C-NKG小鼠用于建立人源实体肿瘤细胞系异种移植(CDX)模型的优势
| 细胞名称 | 品系 | 接种方式 | 接种量 | 接种日期 | 荧光负荷增殖 | 动物死亡日期 | 生存期 |
| THP-1 | NXG系列竞品 | i.v. | 1.00E+06 | 7月1日 | D7 | 7月14日 | 14天 |
| THP-1 | 赛业C-NKG | i.v. | 1.00E+06 | 7月22日 | D3 | 8月24日 | 33天 |
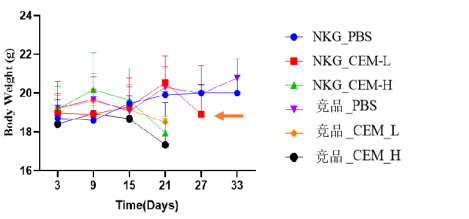
图19. 肿瘤细胞异种移植后小鼠的生长情况。结果显示,利用C-NKG小鼠建立的CDX模型相较竞品CDX模型的生存期更长,荧光负荷能力强,C-NKG在小鼠肿瘤增殖上表现出优势。(CEM:人急性淋巴细胞白血病T淋巴细胞;THP-1:人单核细胞白血病细胞)
- C-NKG小鼠用于人源实体肿瘤细胞系异种移植(CDX)模型的建立
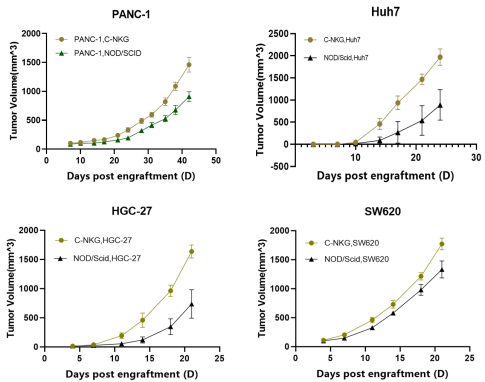
图20. 各类肿瘤细胞皮下异种移植后肿瘤生长曲线。将细胞以皮下注射的形式接种到C-NKG、NOD-Scid小鼠体内,并在不同的时间点测量成瘤体积,细胞接种量为5x106/只。结果显示,人胰腺癌细胞系PANC-1、人肝癌细胞系Huh7、人胃癌细胞系HGC-27和人结肠腺癌细胞系SW620在C-NKG小鼠上均能有效地建立肿瘤模型;C-NKG小鼠体内肿瘤生长的速度以及大小均优于NOD-Scid小鼠。
- C-NKG小鼠用于血液肿瘤细胞移植模型的建立
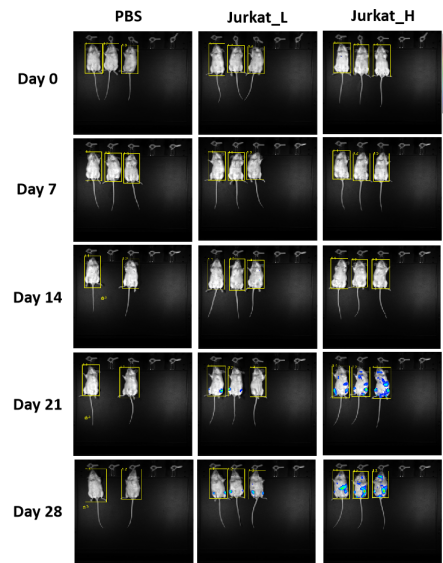
图21. C-NKG小鼠移植人Jurkat细胞后肿瘤的生长情况。将带荧光素酶标记的人T淋巴细胞瘤细胞系Jurkat通过尾静脉注射移植到C-NKG小鼠体内,后续通过荧光发生检测肿瘤的生长情况,结果显示Jurkat淋巴细胞瘤细胞可在C-NKG小鼠体内生长,表明该肿瘤模型的成功建立。
- 利用人淋巴瘤(Raji-Luc)CDX模型验证紫杉醇的抗肿瘤药效
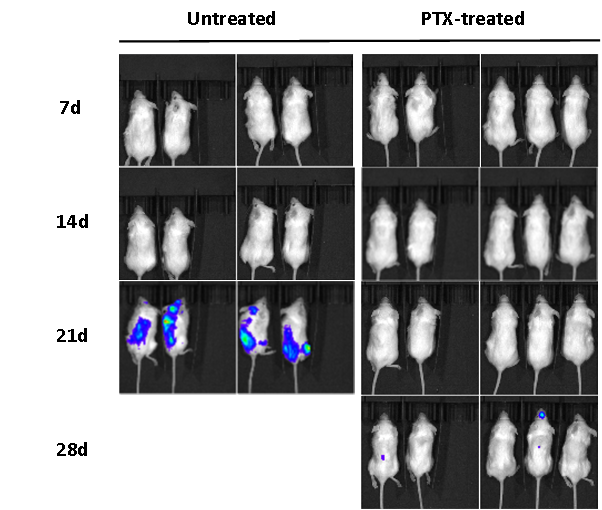
图22. 利用移植肿瘤的C-NKG小鼠验证抗肿瘤药物的药效。将人淋巴瘤(Raji-Luc)细胞系移植到C-NKG小鼠体内后利用抗癌药物紫杉醇(PTX)处理,用于验证C-NKG小鼠体内成瘤的效果以及用于药效验证可靠性。实验数据显示,人淋巴瘤(Raji-Luc)细胞系可在小鼠体内正常生长以建立肿瘤模型并在第28天前导致小鼠的死亡;而抗肿瘤药物紫杉醇(PTX)的使用可有效减轻肿瘤的发展,维持小鼠的生存。
- C-NKG小鼠用于PANC-1胰腺原位模型的建立
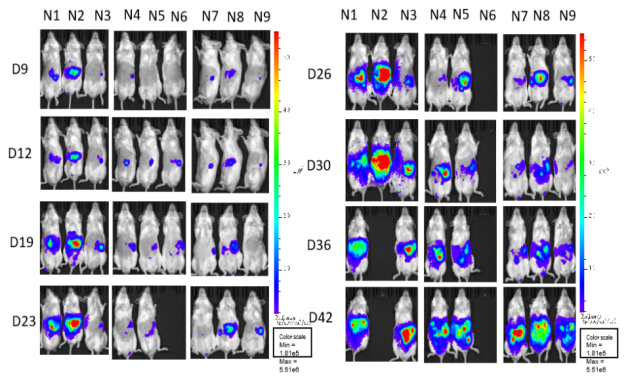
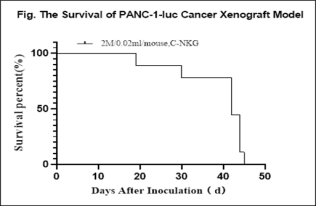
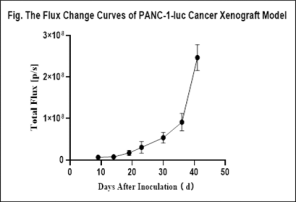
图23. 利用C-NKG小鼠建立胰腺原位模型。将人胰腺癌细胞系PANC-1移植到C-NKG小鼠体内后检测其荧光效应、小鼠生存情况以及总荧光值的平均值。结果显示,PANC-1胰腺原位模型成功建立。
- C-NKG小鼠用于NCI-H441肺原位模型的建立
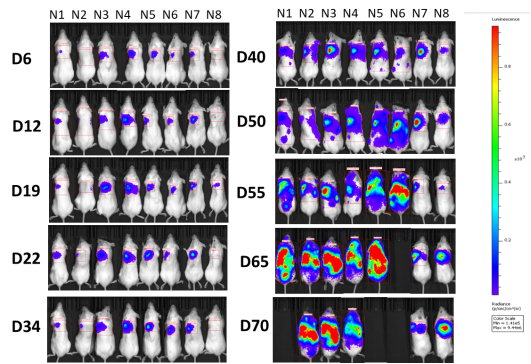
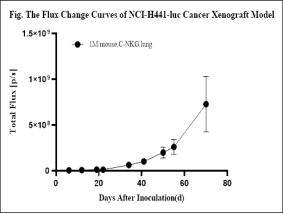
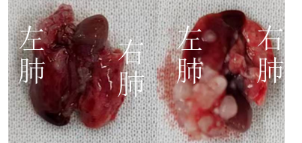
图24. 利用C-NKG小鼠建立肺原位模型。将人肺癌细胞系NCI-H441移植到C-NKG小鼠体内后检测其荧光效应、总荧光值的平均值,并解剖观察小鼠的肺部组织。结果显示,NCI-H441肺原位模型成功建立。
- C-NKG小鼠用于MCF-7-luc乳腺癌骨转移小鼠模型的建立
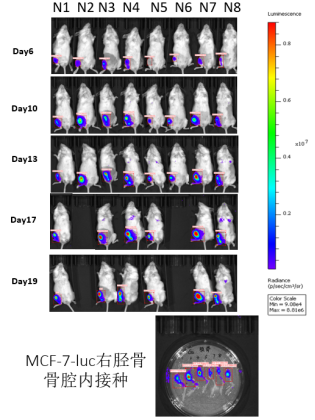
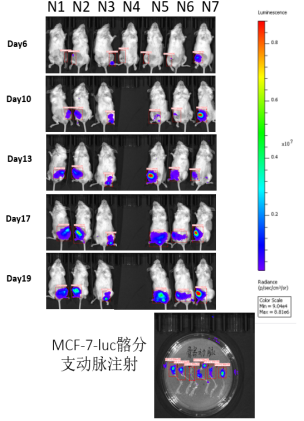
图25. 利用C-NKG小鼠建立乳腺癌骨转移小鼠模型。将人乳腺癌MCF-7-luc细胞以胫骨注射的形式接种到C-NKG(左),细胞接种量为0.5×106/只,同时,以髂分动脉注射的形式接种人乳腺癌MCF-7-luc细胞到C-NKG,细胞接种量为1×106/只(右)。结果显示,MCF-7-luc在C-NKG小鼠上均能有效地建立骨转移肿瘤模型。