尽管AAV病毒作为递送载体在基因治疗中已获得广泛应用,但仍存在局限性。基于AI辅助的高效筛选技术,赛业生物可以提供体外细胞或动物体内使用的创新型AAV纯化病毒,以弥补野生型AAV的不足。
以神经疾病研究为例,天然存在的AAV9血清型因血脑屏障而在脑内的转导效率受到严重限制,而传统的定向进化和理性设计产生的AAV9变体数量有限且耗时耗力。为此,赛业生物利用AI技术指导高性能和多样化序列变体的设计,在小鼠体内注射后使用NGS测序追踪结果,从而筛选出大量中枢神经系统特异性高表达的AAV9变体。
利用自主研发的AI技术和湿实验(wet lab)方法,我们能提供更为安全便捷、精准靶向目标部位的新型AAV病毒变体,其特异性和转导效率经多维度数据验证。为助力神经、眼科等疾病研究,现开放多类型AAV病毒变体的免费试用,期待更好地推动相关疾病研究及新药研发。欢迎拨打400-680-8038或邮件至info@cyagen.com联系我们。
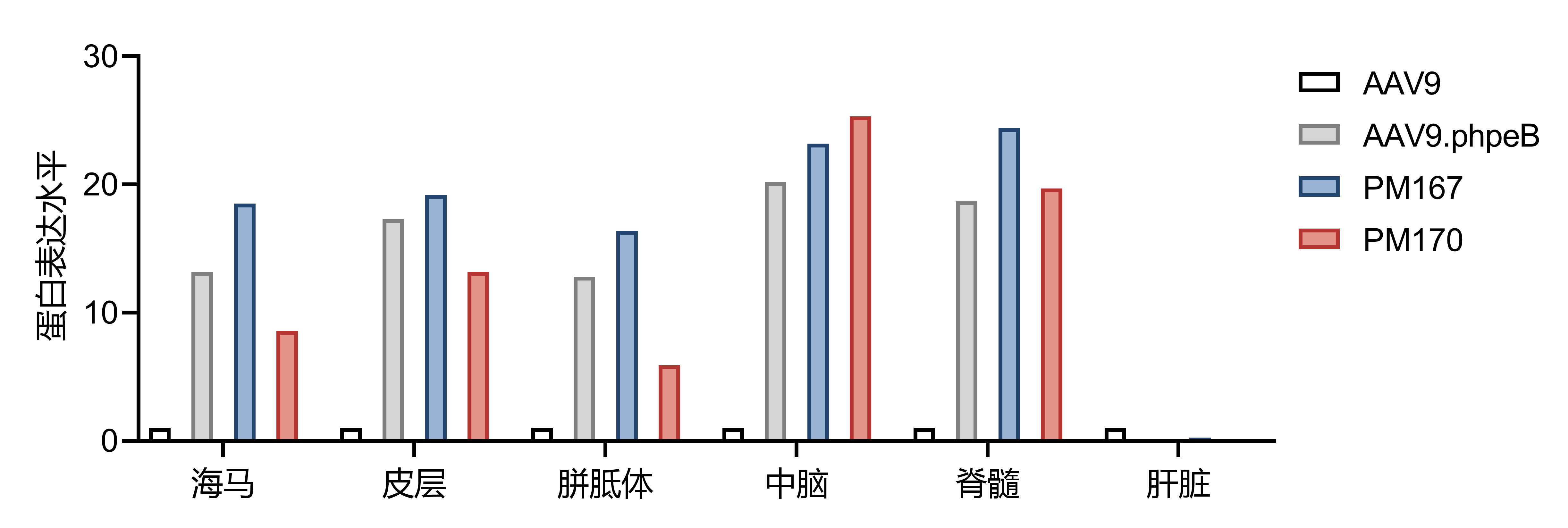
通过AI筛选后的AAV9病毒变体PM167、PM170在C57BL/6J小鼠模型中以较低剂量进行尾静脉注射,数据显示其对各神经相关组织的感染能力强,能高效转导中枢神经系统,同时负靶向肝脏,适用于各类神经疾病的基础和应用研究。
| 组别 | 病毒名称 | 大脑各区域表达能力 |
CAG-EGFP 可试用量 |
CAG-Luc 可试用量 |
申请试用 | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| 海马 | 皮层 | 胼胝体 | 中脑 | 脊髓 | 肝脏 | |||||
| 野生型对照 | AAV9 | 1 | 1 | 1 | 1 | 1 | 1 | 1E12vg | 1E12vg | |
| 阳性对照 | AAV9.phpeB | 13.2 | 17.3 | 12.8 | 20.2 | 18.7 | 0.16 | 1E12vg | 1E12vg | |
| 创新型AAV9病毒变体1 | PM167 | 18.5 | 19.2 | 16.4 | 23.2 | 24.4 | 0.25 | 1E12vg | 1E12vg | |
| 创新型AAV9病毒变体2 | PM170 | 8.6 | 13.2 | 5.9 | 25.3 | 19.7 | 0.14 | 1E12vg | 1E12vg | |
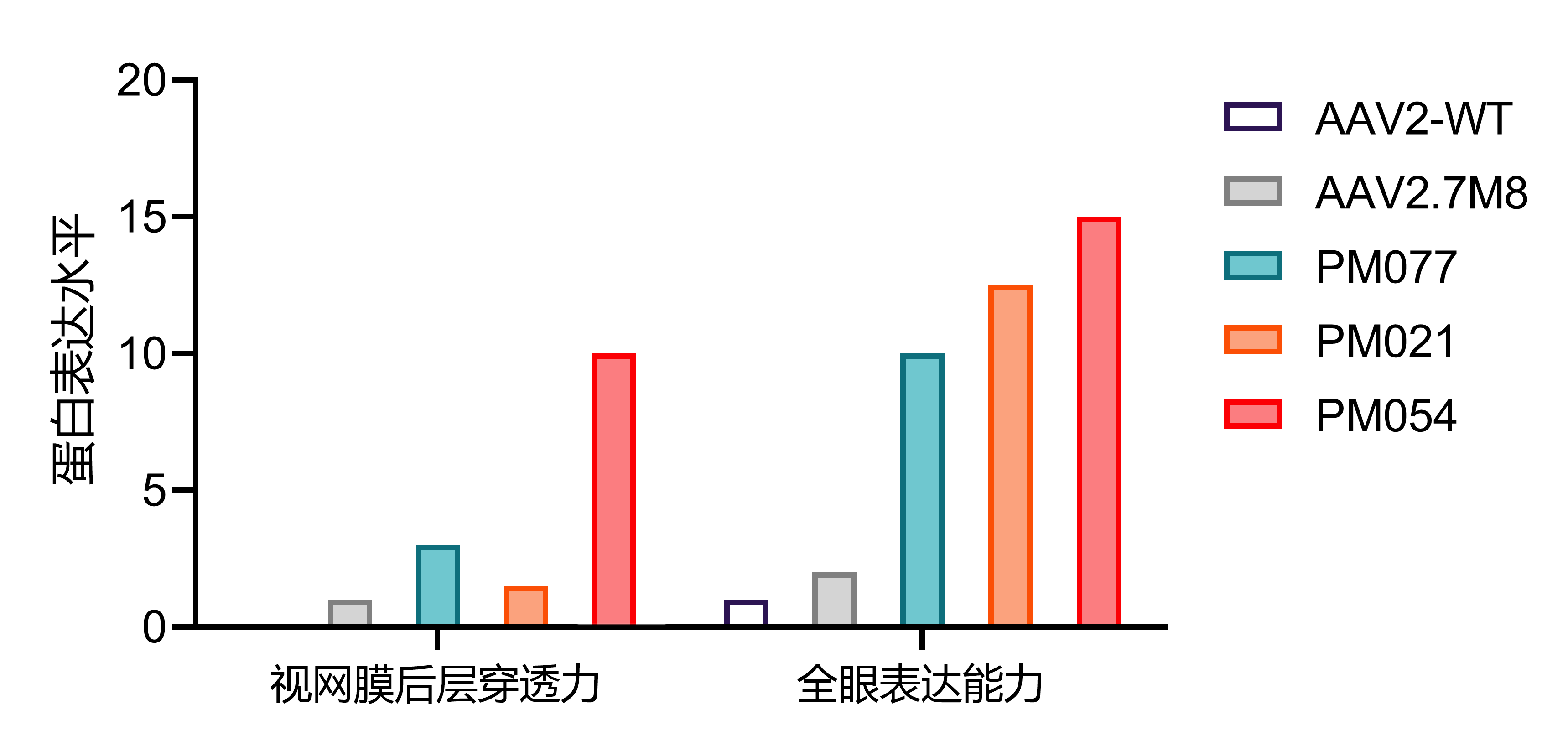
通过AI筛选后的AAV2病毒变体在C57BL/6J小鼠中进行玻璃体腔注射,数据显示病毒变体对眼睛的感染能力强,适用于各类眼底疾病的基础和应用研究。
| 组别 | 病毒名称 | 视网膜后层穿透力 | 全眼表达能力 | CAG-EGFP可试用量 | 申请试用 |
|---|---|---|---|---|---|
| 野生型对照 | AAV2-WT | 0 | 1 | 5E10vg | |
| 阳性对照 | AAV2.7M8 | 1 | 2 | 5E10vg | |
| 创新型AAV2病毒变体1 | PM077 | 3 | 10 | 5E10vg | |
| 创新型AAV2病毒变体2 | PM021 | 1.5 | 12.5 | 5E10vg | |
| 创新型AAV2病毒变体3 | PM054 | 10 | 15 | 5E10vg |
*除以上试用装之外,我们还可提供从AAV载体的设计、构建,到病毒的包装、纯化、表达分析以及功能验证等服务,多种血清型可供选择,以及慢病毒、腺病毒等类型的病毒包装,快拨打400-680-8038或邮件至info@cyagen.com联系我们吧。
赛业生物搭建的AI平台通过整合大数据、云计算、机器学习等多个技术优化AAV9衣壳蛋白,得到大量的候选变体,结果显示预测的中枢神经系统靶向性数据(图1)可信度高,PearsonR高达0.843。
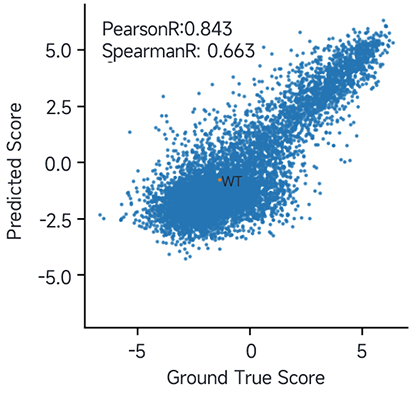 图1. 中枢神经系统感染效率预测
图1. 中枢神经系统感染效率预测
从AI预测的序列中挑选Top序列进行单个验证,在小鼠体内尾静脉注射(5E11vg/只)后21天检测。活体成像结果显示(图2)Top序列在脑内高度富集,其中PM167脑内表达的Luc信号强度约为PHP.eB的2倍,PM170脑内表达的Luc信号强度约为PHP.eB的1.5倍。
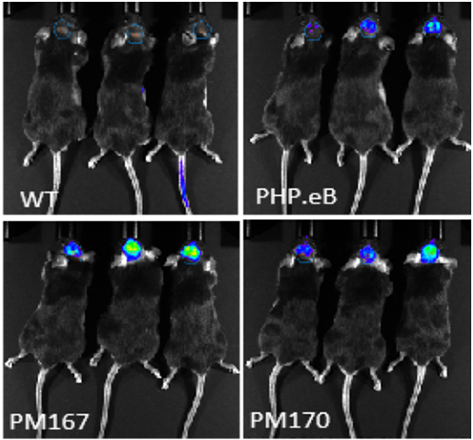
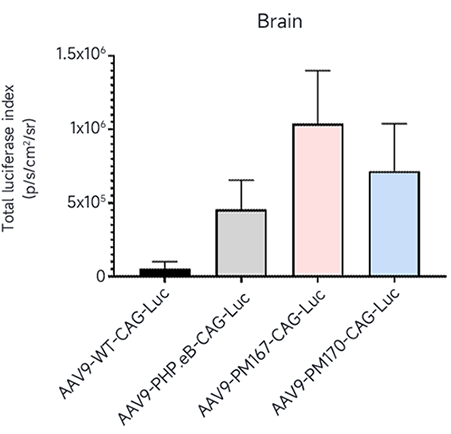 图2. 体内验证大脑感染效率(活体成像, Luc)
图2. 体内验证大脑感染效率(活体成像, Luc)
为了进一步探究Top序列在中枢神经系统不同区域的分布情况,又在小鼠体内尾静脉注射(5E11vg/只)后21天检测。冰冻切片结果显示(图3)PM167在各个脑区(皮层、胼胝体、海马、中脑)以及脊髓的绿色荧光蛋白信号均显著高于PHP.eB,PM170在胼胝体以外的各个脑区以及脊髓的绿色荧光蛋白信号也均高于PHP.eB。
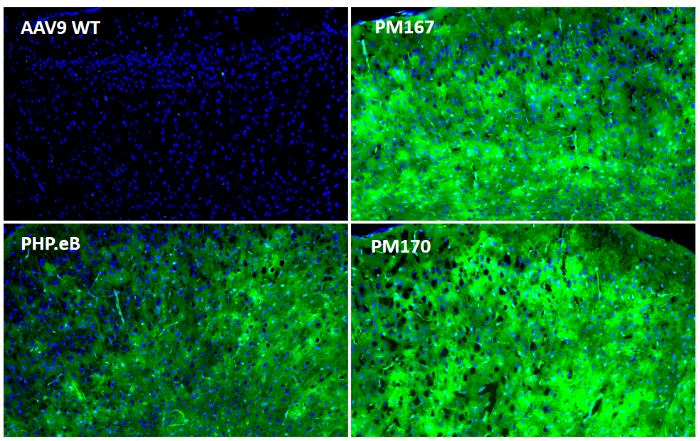
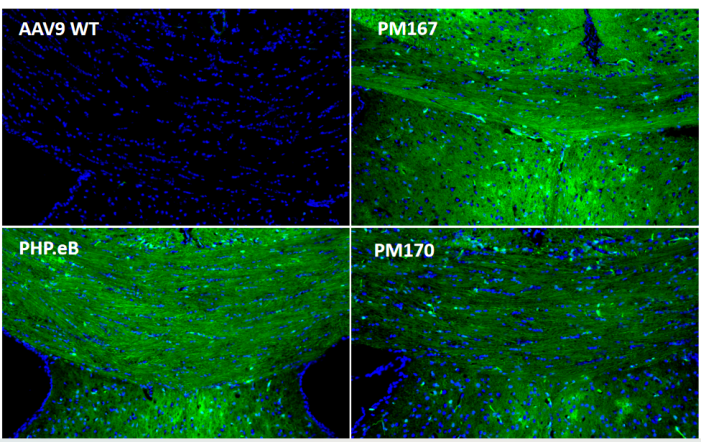
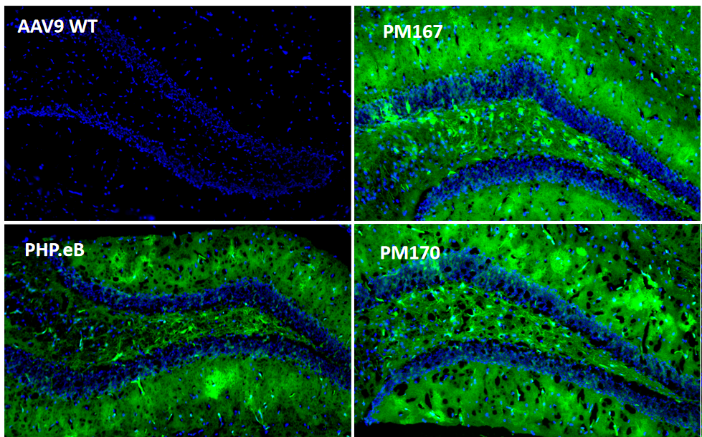
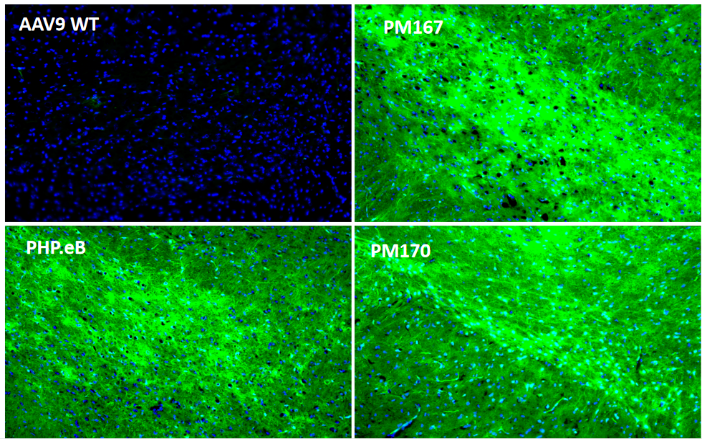
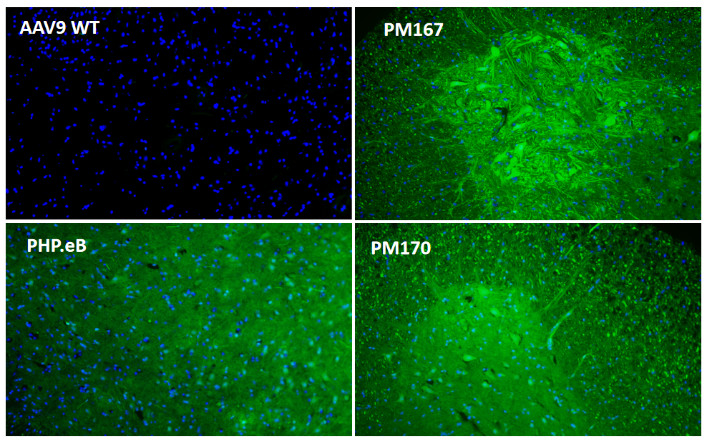
图3. 体内验证大脑和脊髓感染效率(冰冻切片EGFP)
赛业生物搭建的AI平台通过整合大数据、云计算、机器学习等多个技术优化AAV9衣壳蛋白,得到大量的候选变体,结果显示预测的肝脏靶向性数据(图4)可信度高,PearsonR高达0.884。
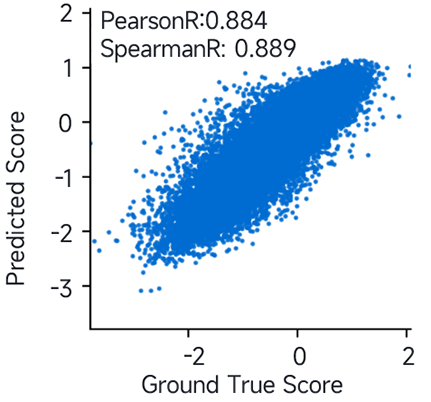 图4. 肝脏感染效率预测
图4. 肝脏感染效率预测
从AI预测的序列中挑选Top序列进行单个验证,在小鼠体内尾静脉注射(5E11vg/只)后21天检测。活体成像结果显示(图5)PM167肝脏负靶向性显著优于PHP.eB,PM170肝脏负靶向性显著优于AAV9野生型(WT),略高于PHP.eB。
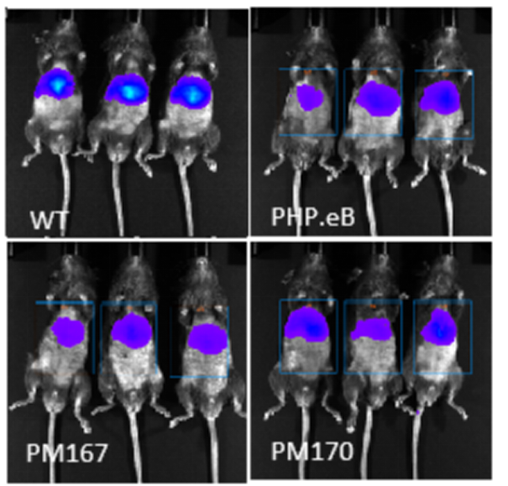
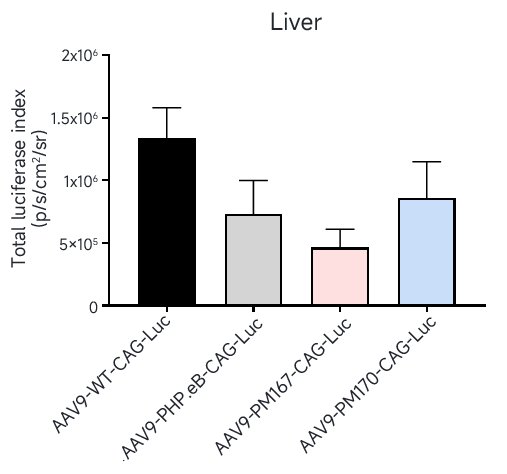 图5. 体内验证肝脏感染效率(活体成像-Luc)
图5. 体内验证肝脏感染效率(活体成像-Luc)
在小鼠体内尾静脉注射(5E11vg/只)后21天检测,冰冻切片结果显示(图6)PM167在肝脏的绿色荧光蛋白信号显著低于PHP.eB,PM170在肝脏的绿色荧光蛋白信号略高于PHP.eB,但仍显著低于AAV9野生型(WT)。
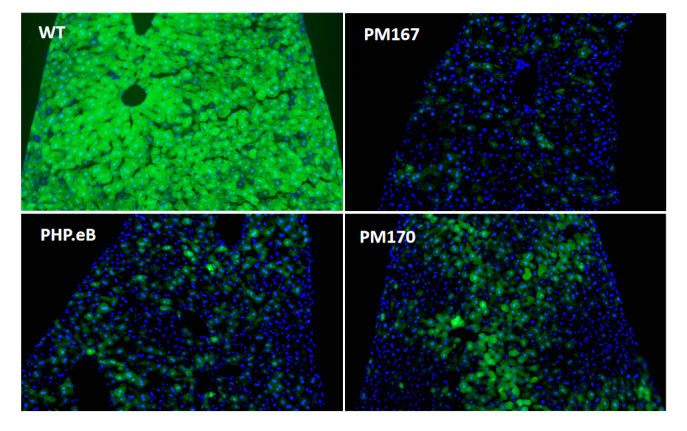
图6. 体内验证肝脏感染效率(冰冻切片EGFP)
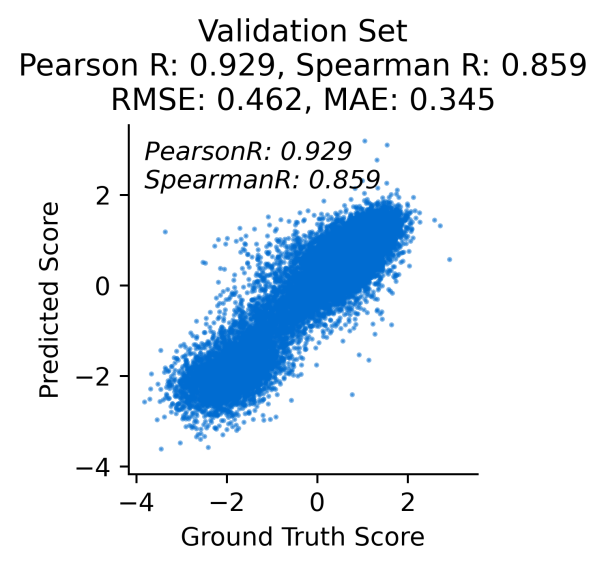
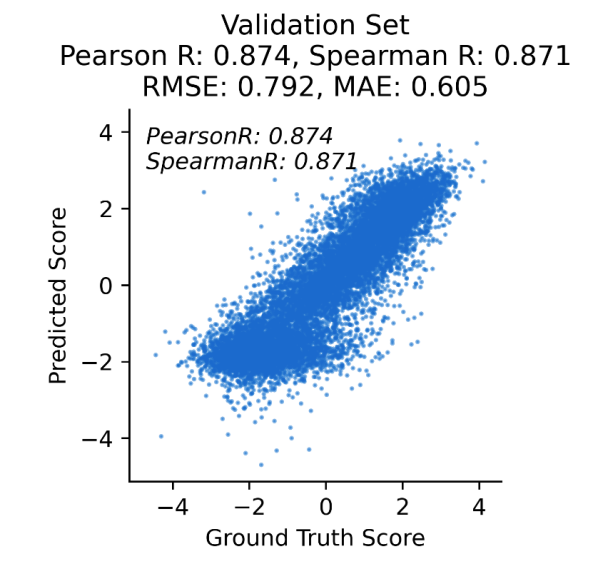
利用赛业生物AI-AAV平台,通过构建高库容突变体质粒文库、包装病毒文库、NGS测序,搭建DualConvLSTM网络构建AAV2产量预测模型,经在测试集上验证模型可信度较高,相关性已达Pearson=0.929,Spearman=0.859(图7);AI构建的视网膜靶向性模型,在测试集上相关性达Pearson=0.874,Spearman=0.871(图8)。
利用产量模型和视网膜靶向性AI模型预测产量和表达能力综合评分高的变体,挑选Top序列,构建RC突变体质粒与AAV2野生型质粒、7M8质粒分别包装Luciferase病毒,经病毒包装、纯化、QPCR滴度检测,3个变体的产量均高于AAV2和AAV2.7M8,其中PM054产量最高为AAV2的3.48倍,PM021和PM077产量分别是AAV2的1.5倍和2.01倍。
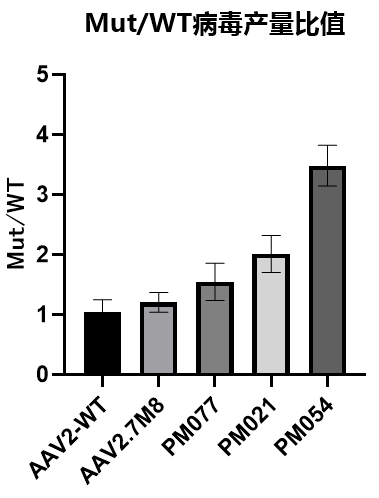 图9. AI预测AAV2变体病毒产量
图9. AI预测AAV2变体病毒产量
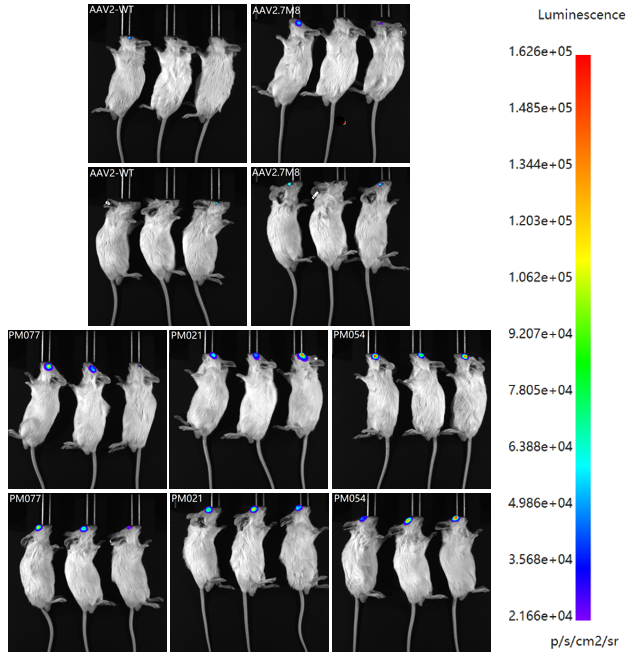
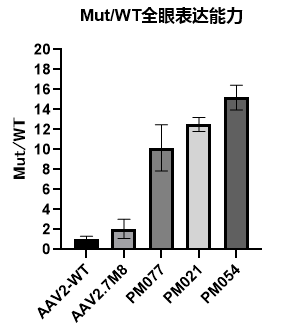
将包装的Luciferase病毒玻璃体腔注射小鼠,注射剂量为3E+9vg/只眼,3W后通过活体成像和化学发光法检测Luciferase表达情况。活体成像(图10)显示,3个变体Lucifersae信号强度均高于AAV2和AAV2.7M8。为了对其进行更准确的定量,处死小鼠摘取眼球,匀浆后进行化学发光检测,PM054变体Lucifersae表达量最高,为AAV2的15倍,PM021和PM077分别为AAV2的12.5倍和10倍。
为了进一步验证变体体内感染效果并探究感染的细胞类型,包装EGFP病毒,玻璃体腔注射小鼠(3E+9vg/只眼),3W后通过活荧光眼底拍照检测EGFP整体表达情况,摘取眼球进行病理检测。眼底拍照结果(图12)显示,PM054的GFP信号最强,3种变体荧光信号均显著高于AAV2和AAV2.7M8。
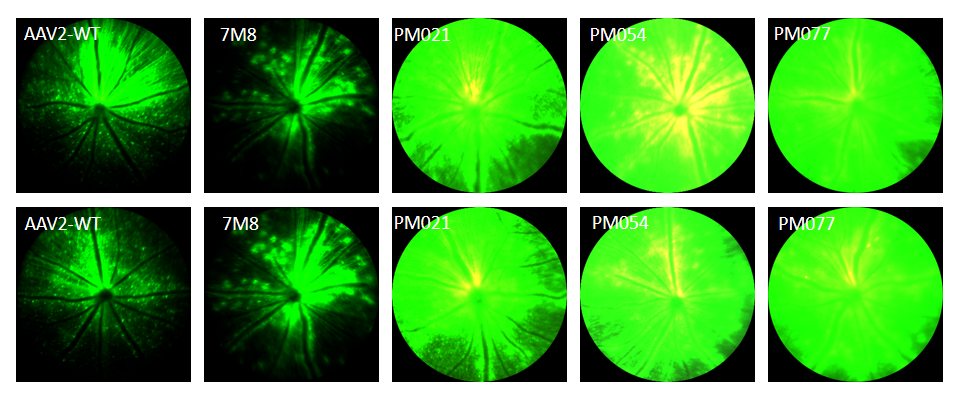
图12. 体内验证全眼感染能力(眼底拍照)
对眼球冰冻切片进行DAPI染色,结果显示,3种突变体的感染范围均大于AAV2-WT和AAV2.7M8,其中PM021和PM054几乎可以感染整圈视网膜区域。从感染层次看,AAV2-WT仅感染RGC层细胞,AAV2.7M8具有一定的穿透能力,可穿透至视网膜后层感染少量的视神经细胞。3种变体穿透能力均强于AAV2-WT和AAV2.7M8,能感染视网膜从RGC到PRC的各层细胞,其中PM054对视神经细胞的感染率和表达效果最好,感染视网膜后层的能力约为AAV2.7M8的10倍。
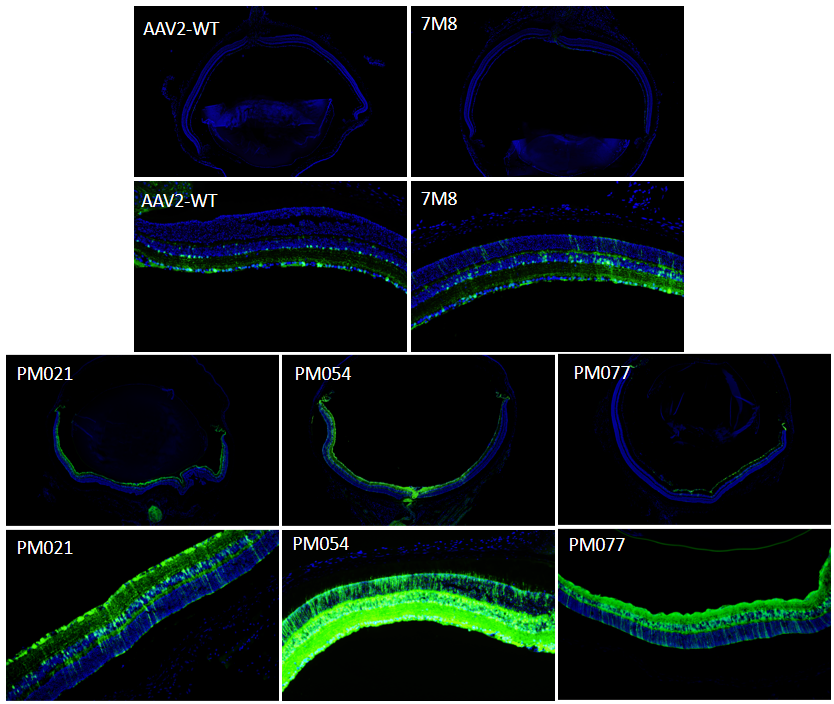
图13. 体内验证全眼表达能力及视网膜后层穿透能力