| 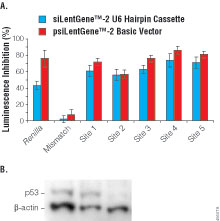
图2. 使用psiCHECKTM -2载体选择p53基因的靶位点。图A. 将HEK293T细胞接种于96孔板,密度为3,000细胞/孔。利用Sgf
I 及Not I内切酶位点,将人p53 cDNA克隆到psiCHECKTM-2载体。分别用每孔0.02μg
psiCHECKTM-2载体:p53及每孔0.08μg siLentGeneTM
-2 U6发夹盒(兰色柱)或基本型psiCHECKTM-2载体(红色柱)转化细胞。CodeBreakerTM
siRNA转化试剂(E5052)用于转化DNA盒结构,TransFastTM转化试剂(E2431)用于转化载体DNA。针对人p53的5个靶位点的shRNA作为对照。使用了针对海肾荧光素酶完全互补的或4个碱基错配的shRNA。将这些数据与用针对非特异性序列shRNA转化细胞的数据进比较。转化后48小时,使用Dual-Luciferase®
报告1000检测系统(Cat.#E1980)测定海肾荧光素酶及萤火虫荧光素酶活性。数据以针对不同靶位点的shRNA产生的海肾荧光素酶活性(经过校正)抑制百分比表示。数据为12孔的平均值加减标准差。图B.
用HEK293T细胞测定抑制作用并用Western blot方法进行分析。单独用非特异序列处理细胞(泳道1),用克隆了非特异序列(泳道2)或p53靶位点4的psiCHECKTM-2基本型载体处理细胞(泳道3)。瞬间检测于72小时后进行。
平,提示理想的RNAi效应来自于较大的DNA载体结构。
为了验证上述方法,需要证明表达针对p53靶位点4的shRNA对内源p53蛋白的抑制作用。图2B给出了用表达针对非特异性序列(泳道2)与针对p53靶位点4(泳道3)的psiCHECKTM-2基本型载体转化HEK293T细胞的Western
blot分析结果。分析结果显示,在shRNA处理的细胞中,p53蛋白含量(用β-actin校正)的降低超过了80%。,确认了使用psiCHECKTM载体得到的结果。
监测RNAi的动力学
使用psiCHECKTM载体中的海肾荧光素酶可以实时监测由RNAi介导的海肾荧光素酶在活细胞中的表达。图3显示用含有人p53
cDNA 的psiCHECKTM -1载体与表达针对
|
|
海肾荧光素酶或非特异性序列或p53的psiCHECKTM-2基本型载体共转化的细胞中海肾荧光素酶活性的变化。于转化后17小时向培养孔中加入非裂解EnduRenTM
活细胞底物,监测其后26小时到41小时的相对光强度。我们观察到,在用针对非特异性序列shRNA转化的细胞中,海肾荧光素酶活性显著升高,而用针对海肾荧光素酶或p53靶位点4的shRNA转化的细胞中,海肾荧光素酶的表达只有轻微的升高。在用功能性shRNA转化的细胞中于41小时测到了对肾荧光素酶80%的抑制率。上述结果与图2中用终点分析法得到的抑制结果相一致。实验终了时,加入CellTiter-Glo®荧光细胞存活检测试剂(Cat.#G7570)
以确定细胞的生存状态。当海肾荧光素酶信号用每孔中的活细胞数校正后,抑制水平没有变化,但是,在信号变化方面,孔与孔之间表现出显著的降低(数据未列出)。
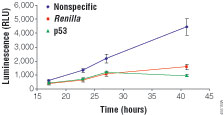
图3. 活细胞中海肾荧光素酶活性变化的测定。将HEK293T细胞接种于96孔板,密度为3,000细胞/孔。培养过夜后用转化混合物处理细胞。转化混合物的组成为:35μl
无血清培养基,0.3μl TransFastTM转化试剂(E2431),每孔0.02μg
psiCHECKTM-1载体:p53及每孔0.08μg psiLentGeneTM
-2基本型载体。本实验中psiLentGeneTM -2基本型载体表达针对p53,海肾荧光素酶或非特异序列(阴性对照)的shRNA。培养1小时后,向每孔加入100μl含血清培养基。转化后17小时,加入EnduRenTM活细胞底物(E6481),使其终浓度为60μM,并监测海肾荧光素酶活性。
对多个目标筛选多个shRNA
我们分析了由一组caspase基因RNAi引起的沉默效应以确定本系统在鉴定其它基因的有效RNAi位点方面的可用性。我们使用siLentGeneTM
-2 U6发夹克隆系统提供的快速PCR方法,得到了shRNA。用针对caspase不同靶位点的PCR产物与含有caspase基因编码cDNA
的psiCHECKTM-2载体共转化细胞。转化后48小时测定海肾荧光素酶及萤火虫荧光素酶的活性。柱状数据列于表4。图A,用克隆了caspase-8
|