| 柱: HiTrap 1 ml
样品: E. Coli 匀浆液中的GFP
缓冲液A: 50 mM Tris/HCl, pH 8.2
缓冲液B:50 mM Tris/HCl, pH 8.2 + 1 M NaCl
流速: 1 ml/min (156 cm/h)
梯度: 0-100% B, 15 个柱体积
系统: AKTAexplorer 100
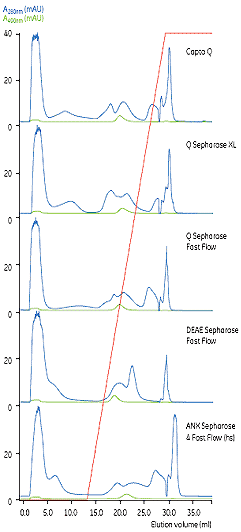
图2. E. Coli 中表达的GFP与不同介质的选择性和分离能力的比较。根据280 和490 的UV曲线综合分析,Capto Q的选择性最优。 |
|
Column: Tricorn 5/100, 10 cm bed height
Medium: Capto Q
Sample: GFP in E. coli homogenate
Buffer A: 50 mM sodium phosphate pH 7.0;
50 mM Tris/HCl, pH 7.6;
50 mM Tris/HCl, pH 8.2
Buffer B: A + 1 M NaCl
Flow: 600 cm/h
Gradient: 0-100% B, 15 column volumes
System: ÄKTAexplorer 100
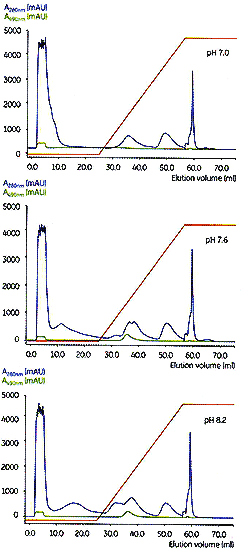
图3. Capto Q的pH 优化结果。
|
|
pH 优化
图3 显示了pH 优化结果。在pH 7.0洗脱时没有490 nm的吸收峰,表明在该pH下GFP不结合Capto Q。pH
7.6和pH 8.2的层析图十分相似,但是,pH 7.6 的峰略宽。在稍高的pH下洗脱的280 nm曲线,能从GFP中分离出更多杂质。因此,pH 8.2 被确认为最佳pH 并用以进行中试。
动态结合载量
Capto Q和Q Sepharose Fast Flow的动态结合载量示于表1.
工艺过程优化
以最初的梯度洗脱结果为基础,建立起一个由三步组成的阶段洗脱的方案。为了节省时间及减少缓冲液的消耗,对平衡/再平衡/冲洗液的体积的工艺过程进行了优化。表2 叙述了优化的方法。第一个洗脱步骤可作为在GFP蛋白冲洗下来之前的组分的冲洗步骤。GFP靶蛋白在第二步进行收集,而步骤3 在在位清洗(CIP) 之前,以避免高荷电物质在柱上沉淀。由于除去了清洗步骤,整个工艺过程时间可大大缩短。此外,工艺优化也使平衡/再平衡步骤的时间缩短。
|