
-

生物通官微
陪你抓住生命科技
跳动的脉搏
一种新的基因表达调控方式:小分子RNA[创新技巧]
【字体: 大 中 小 】 时间:2003年12月19日 来源:
编辑推荐:
RNA一度被认为仅仅是DNA和蛋白质之间的“过渡”,但越来越多的证据清楚的表明,RNA在生命的进程中扮演的角色远比我们早前设想的更为重要。RNA干扰(RNA interference)的发现使得人们对RNA调控基因表达的功能有了全新的认识,更因为可以简化/替代基因敲除而成为研究基因功能的有力工具,因此格外引人注意,在2002年度Science评选的10大科学成就中RNAi名列榜首。随着对小分子RNA研究的不断深入,研究人员开始认识到:小分子RNA的世界一点都不小。有人推测:小分子RNA可能代表发现了一个新层次上的基因表达调控方式。生物通早在去年底到今年初已经有很多文章介绍有关siRNAs以及其在RNA干扰中的作用(参见综述:RNAi回顾)以及研究应用方法,在这里生物通继续为我们的用户介绍另一种越来越引人注目的小分子RNA——microRNA。
什么是miRNA
MicroRNAs (miRNAs)是一种大小约21—23个碱基的单链小分子RNA,是由具有发夹结构的约70-90个碱基大小的单链RNA前体经过Dicer酶加工后生成,不同于siRNA(双链)但是和siRNA密切相关。据推测,这些非编码小分子RNA(miRNAs)参与调控基因表达,但其机制区别于siRNA介导的mRNA降解。第一个被确认的miRNA是在线虫中首次发现的lin-4 和let-7,随后多个研究小组在包括人类、果蝇、植物等多种生物物种中鉴别出数百个miRNAs。
miRNA 的特征
已经被鉴定的miRNAs据推测大都是由具有发夹结构、约70个碱基大小形成发夹结构的单链RNA前体经过Dicer酶加工后生成的,有5’端磷酸基和3’羟基,大小约21—25nt的小分子RNA片断,定位于RNA前体的3’端或者5’端。
最近3个研究小组分别从线虫、果蝇和Hela细胞中鉴定的100个新miRNAs中,有15%跨越线虫、果蝇和哺乳动物基因组具有高度的保守性(只有有1—2个碱基的区别),Lau 和Bartel 实验室的同事更加认为:所有的miRNAs可能在其他物种中具有直向同源物(Ortholog,指那些起源于同一祖先,在不同生物体中行使同一功能的基因群就可比作为一个门类,这些类似的基因被称为“直向同源物”)。
Bantam 最早被认为是果蝇中参与细胞增殖的一个基因位点。已知几个包含增强子的转座子插入跨越这个位点的一段12.3kb区域会导致果蝇的眼和翅重复生长,而由转座子介导的一段跨越该位点的23kb片断缺失则导致突变果蝇个体小于野生型果蝇。Cohen和同事用一段3.85kb的片断导入21kb片断缺失的果蝇中使其恢复原来的大小。但是奇怪的是表达这个3.85kb片断中的EST却没有同样的效果。Cohen将这个片断和疟蚊Anopheles gambiae的同源序列进行比较,发现一段90bp的高度保守区,经过RNA folding program (mfold)发现这个保守序列可以形成发夹结构,使得这个区段很象是一个miRNA的前体。这个结果经过Northern blot证实突变果蝇的幼体缺少一个21bp的bantam miRNA ,用这个90bp的mRNA前体经过一系列的“功能缺失”—“功能恢复”实验,证实 bantam miRNA在细胞增殖中的作用。研究人员用计算机程序检索在hid mRNA的3’非编码区找到了bantam的3个潜在的结合位点( hid是果蝇中一个诱导凋亡的基因),并证实 bantam miRNA抑制hid 的翻译而非转录。
miRNAs的表达方式各不相同。部分线虫和果蝇的miRNA在各个发育阶段的全部细胞中都有表达,而其他的miRNA则依据某种更为严谨的位相和时相的表达模式(a more restricted spatial and temporal expression pattern)——在不同组织、不同发育阶段中miRNA的水平有显著差异。
miRNA的功能
对microRNAs (miRNAs)的研究正在不断增加,原因是科学家开始认识到这些普遍存在的小分子在真核基因表达调控中有着广泛的作用。在线虫,果蝇,小鼠和人等物种中已经发现的数百个miRNAs中的多数具有和其他参与调控基因表达的分子一样的特征——在不同组织、不同发育阶段中miRNA的水平有显著差异,这种miRNAs表达模式具有分化的位相性和时序性( differential spatial and temporal expression patterns),提示miRNAs有可能作为参与调控基因表达的分子,因而具有重要意义。
第一个被确认的miRNA——在线虫中首次发现的lin-4 和let-7,可以通过部分互补结合到目的mRNA靶的3’非编码区(3’UTRs),以一种未知方式诱发蛋白质翻译抑制,进而抑制蛋白质合成,通过调控一组关键mRNAs的翻译从而调控线虫发育进程(reviewed in Pasquinelli 2002)。
bantam miRNA是第一个被发现有原癌基因作用的miRNA。除了lin-4、let-7,已知还有一些miRNAs可能参与在细胞分化和组织发育过程中起重要作用的基因的转录后调控,例如mir-14、mir-23 等。
在植物miRNAs的研究中有两条线索提示miRNAs可能参与植物的发育过程。一是在carpel factory (car) 突变株中3个miRNAs的表达水平显著下降。CARPEL FACTORY 是一个类似Dicer的酶,参与植物的发育,其缺失突变株表现为胚胎和叶片发育的缺陷。实验结果提示这种缺陷是由于缺少miRNAs加工而造成的。多数的植物miRNAs在某些特定组织中高水平表达也提示他们可能参与了植物组织的发育。
对一部分miRNAs的研究分析提示:miRNAs参与生命过程中一系列的重要进程,包括早期发育(Reinhart 2000),细胞增殖,细胞凋亡,细胞死亡(Brennecke 2003),脂肪代谢(Xu 2003)和细胞分化(Kawasaki 2003)。此外,一个研究表明,2个miRNAs水平的下降和慢性淋巴细胞白血病之间的显著相关,提示miRNAs和癌症之间可能有潜在的关系(Calin 2002)。
由于miRNAs存在的广泛性和多样性,提示miRNAs可能有非常广泛多样的生物功能。尽管对miRNA的研究还处于初级阶段,据推测miRNAs在高级真核生物体内对基因表达的调控作用可能和转录因子一样重要。有一种看法是:miRNAs可能代表在一个新发现的层次上的基因表达调控方式。
然而,大多数miRNAs的功能仍然是个谜。
miRNA的作用方式
最早被发现的两个miRNAs——lin-4 and let-7被认为是通过不完全互补结合到目标靶mRNA 3’非编码区端,以一种未知方式诱发蛋白质翻译抑制,进而抑制蛋白质合成,阻断mRNA的翻译。多个果蝇miRNAs也被发现和他们的目标靶mRNAs的3’非编码区有部分同源。由于miRNAs和其潜在的目标靶之间并非完全互补,这使得通过信息学的方法鉴定miRNA的目标靶位点变得困难。因而也无法确定miRNAs的作用方式是什么,以何种机制影响mRNA的翻译,以何种方式调控基因表达。miRNAs的作用目标靶和活性机制一直是各地的研究人员的关注热点。
在植物中目前有一个miRNA和3个潜在的目标靶基因完全互补(这些scarecrow 基因编码潜在的转录因子),尽管目前还不清楚这些基因是否就是miRNA的目标靶,这仍是第一次发现miRNA 和其潜在的目标靶完全互补,也提示miRNA可能包含和siRNA类似的作用方式。
识别 miRNAs的方法
多个研究小组采用生物化学结合是生物信息学的方法开展对miRNAs的研究工作。由于据推测都是由Dicer酶降解RNA得到的,21—23个碱基大小、有5’端磷酸基和3’羟基的RNA片断,有的实验室采用改良的定向克隆方法来筛选具有相同特征的小分子——筛选一定大小的RNA分子,连接到3’和5’的适配子(adapters),逆转录并通过PCR扩增、亚克隆并测序。miRNA前体在基因组上的定位和聚类是通过向基因组数据库查询进行。这个方法有助于判断miRNAs是否是mRNAs、tRNAs、rRNAs等分子的降解产物。
有的实验室通过一种RNA folding program ’mfold’ 来判断C. elegans 和C. briggsae 之间的高度保守区域是否含有潜在的miRNA前体,然后用Northern Blots的方法来确定这些miRNAs是否真的表达了。
尽管有数百个miRNAs通过生化或者是生物信息学的方法被鉴别出来,已经鉴别出来的miRNAs只不过是沧海一粟,由于很多已经鉴别出来的miRNAs是从单个克隆中鉴别出来的,所以可以假设还有很多miRNAs在分离和鉴定过程中被“漏掉”了,测序工作还远远不够。
miRNA和siRNA的关系
miRNA和siRNA之间的关系令人迷惑。从表面上说,一个是非编码的单链小分子RNA,在进化上高度保守,通过翻译抑制调控基因表达而不影响转录本的稳定性;另一个是针对编码区的双链小分子RNA,每个转录本都可能有很多个siRNAs,是通过降解目标靶,在转录后调控基因表达。由于每个mRNA模版可能产生很多个siRNAs,要给每个siRNA定一个基因的名字就很困难。miRNA是进化进程中高度保守的,因此给直向同源物一个同样的名字可能有助于了解他们的功能,而给另一个物种中一段无关的序列一个同样的名字就容易造成混乱。
然而,据推测miRNAs通常是由较大的(7090 nt)的茎环结构(发夹结构)前体经Dicer酶切割得到的,而Dicer同样负责将长双链RNA切割为siRNA,而且二者的长度也差不多,同样有调控基因表达功能。因而这两类小分子RNA之间的关系格外令人关注。
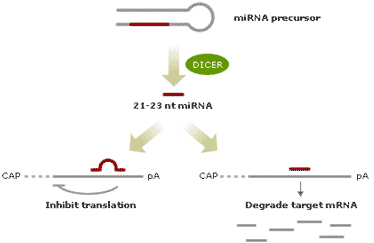
两个广为人知的miRNA——在线虫中首次发现的lin-4 和let-7,可以通过部分互补结合到目的mRNA靶的3’非编码区(3’UTRs),通过一种未知方式诱发蛋白质翻译抑制从而抑制蛋白质合成。这种结合并不诱导mRNA靶的降解,就是说作为翻译抑制子本身不影响对应mRNA的丰度,其原因据推测是由于miRNA和结合位点之间不完全互补。这就区别于siRNA的介导的mRNA的降解。但是其他一些miRNAs可能以类似siRNA的方式介导目的RNA的降解。实验表明引入和let-7目的mRNA靶完全互补的miRNA会诱导mRNA靶的降解。还有实验结果表明一些miRNA,包括在植物中发现的Scarecrow miRNA,能结合完全互补的mRNA链从而降解mRNA序列,抑制蛋白合成。这提示miRNAs可以和siRNAs一样作用,这两种小分子RNA作用通路可能有重叠的部分。这种重叠同样提示siRNAs可能也有和miRNAs同样的功能。
一个很有趣的实验证实这个观点:Doench和同事挑选一个已知在体内可以有效使CXCR4基因沉默的siRNA,然后在荧光素酶报告基因的3’端插入对应的CXCR4结合位点——其中一个拷贝是插入一个完全匹配的CXCR4结合位点,另一个拷贝插入4个只有3’和5’端匹配,而中间不同的CXCR4结合位点,这样选定的siRNA就不能完全结合到这个结合位点——中间形成一个突起的不匹配的环。将这两个拷贝转入Hela细胞并用siRNA诱导基因沉默。结果很有趣——两个实验都录得荧光素酶活性下降了超过10倍,RT-PCR和Northern分析证实,第一个实验的荧光素酶转录本下降了超过10倍,这正是正常的siRNA介导的RNAi反应,目标靶mRNA降解导致表达水平的下降,而第二个实验中荧光素酶转录本仅仅下降1.2倍,这种目的基因表达水平下看起来象源于miRNA介导的翻译抑制降,而不是siRNA介导的影响mRNA的稳定性导致。实验表明:siRNA可能以miRNA的方式作用于mRNA。实验人员还进行了另一个实验:改变第二个实验中的不匹配环的碱基序列看起来不影响抑制效果,但是siRNA和报告基因上的结合位点的匹配程度越高抑制效果越好,增加siRNA的量,抑制效果越好——这一点和siRNA抑制的情况一样——唯一不同的是:完全匹配的结合位点(siRNA作用方式)可以单独起作用而相互不影响,而增加不完全配对的结合位点(注意在第二个实验中用了4个CXCR4结合位点)的个数对翻译抑制有显著的加乘作用。
在哺乳动物细胞中还没有找到内源的siRNA,外源的siRNA介导的RNAi作用正是一种抵御机制。而miRNAs则广泛存在于哺乳动物细胞中,从理论上推测可能参与多种调控作用。这两种小东西的作用机制和相互关系的本质就显得更加扑朔迷离。如何在实验中正确鉴定siRNA和miRNA,甚至是其他的小分子RNA都成为一个值得关注的问题。
未来要解决的问题
miRNAs在多个物种中广泛被发现,而且在进化上高度保守。这些“小玩意儿”留给我们一大堆谜团:miRNA的确切功能是什么?它的目标靶是什么?作用机制是什么?也许需要对植物或者线虫的基因组进行miRNAs突变株的筛选,在果蝇中可以用targeted-disruption缺失miRNA序列。对miRNA突变株伴随的表型缺失进行研究,有助于解释miRNAs的功能。
正如Phillip Zamore说的:“如果miRNAs在进化的进程中如此高度保守而没有任何实际功能,那真是大自然拿科研人员开涮——而且是一个残酷的玩笑”。
研究miRNA的新工具
随着小分子RNA日益收受到研究人员的重视,很多研究小分子RNA的新方法不断推出。
小分子RNA的分离
由于小分子RNA可能参与分化、发育、组织生长、脂肪代谢等生理过程,在不同的组织和发育阶段的表达水平有所不同,进一步了解小分子RNA的生物功能需要确定其在各种生物样品中的表达水平,因而需要一种精确的定量纯化方法,从而得到可信的数据。
现行的RNA纯化方法包括有机溶剂抽提+乙醇沉淀,或者是采用更加方便快捷的硅胶膜离心柱的方法来纯化RNA。由于硅胶膜离心柱通常只富集较大分子的RNA(200nt以上),小分子RNA往往被淘汰掉,因而不适用于小分子RNA的分离纯化。有机溶剂抽提能够较好的保留小分子RNA,但是后继的沉淀步骤比较费时费力。mirVana miRNA Isolation Kit是采用玻璃纤维滤膜离心柱(glass fiber filter,GFF),既能够有效富集10mer以上的RNA分子,又能够兼备离心柱快速离心纯化的优点,是一个不错的选择。对于特别稀有的分子,由于需要分离大量RNA而导致高背景而降低灵敏度,还可以进一步富集10mer到200bp的小分子RNA来提高灵敏度。
小分子RNA探针的制备
方法其实很简单:只需要准备目的基因的一小段寡核苷酸序列,3’端另外增加8个和T7启动子互补的碱基,将这段寡核苷酸和T7启动子引物退火,用Klenow大片断补齐得到双链的转录模版,然后用T7 RNA聚合酶、rNTP和标记物混合,体外转录得到标记的小分子RNA探针。这种方法可以快速制备各种标记(同位素、非放射性标记均可)的小于100nt的小分子RNA探针,适用于包括RPAs,Northerns 和原位杂交等各种方法检测小分子核仁RNA( small nuclear RNA,snRNA),small interfering RNA (siRNA),,micro RNA (miRNA)和 mRNA。非放射性标记的探针还可以用于原位杂交研究miRNA或者mRNA在组织中的分布。
小分子RNA的检测
由于小分子RNA是一类很小的分子,部分小分子RNA表达水平可能很低,因而需要极为灵敏而定量的分析工具。由于其分子很小,用RT-PCR的方法来定量研究非常困难,目前多数研究人员采用Northern Blots——一种技术复杂而费力的方法来检测小分子RNA的存在。传统的Northern Blot的方法是是用探针检测固相支持物(膜)上的目标分子,由于用探针检测液相中的目标分子远比检测固相中的目标更为灵敏,生物通在这里为大家推荐一种基于核酶保护分析方法改进的新方法——将同位素标记好的小分子RNA探针和待检测样品混合杂交,未杂交的RNA和多余的探针用单链核酸酶消化,然后使核酸酶失活,并纯化杂交的RNA分子,最后通过变性胶电泳放射自显影检测结果。这个基于液相杂交的新方法不但操作简单而快速,而且灵敏度极高——可以半定量检测少至10ng总RNA模版中的小分子RNA,或者说,可以检测attomole (10-18 mol)级别的靶目标!灵敏度是Northern Blot的100倍。除此之外,研究人员还可以在同一个样品中同时检测多个小分子RNA和长的RNA模版。应该说,这个灵活巧妙的设计可以为从事小分子RNA实验的研究人员带来不少方便。
总而言之,无论是siRNA, miRNA, snRNA还是其他的小东西,小分子RNA研究的不断深入将帮助我们揭示更多生命的奥秘。