
-

生物通官微
陪你抓住生命科技
跳动的脉搏
北大学者发表Cell论文:首次发现外源植物蛋白可抗肿瘤,或成为治疗癌症的新方法
【字体: 大 中 小 】 时间:2022年07月29日 来源:Cell
编辑推荐:
癌细胞具有细胞周期不可控激活的特点,microRNA缺乏驱动肿瘤发生。RNA依赖的RNA聚合酶(RDR)是植物小RNA介导的免疫反应所必需的,但在脊椎动物中不存在。在本研究中,我们发现植物RDR1的异位表达通常可以抑制癌细胞的增殖。在许多人类原发性肿瘤中,具有1-nt-短3'端异常microRNA亚型广泛积累。具有核苷酸转移酶活性的RDR1可以通过单核苷酸识别和修饰存在问题的无ago2的microRNA双链,恢复其2nt悬挑结构,最终挽救ago2的加载效率,提高整体miRNA表达,特异性抑制癌细胞周期。RDR1广泛的抗肿瘤作用,可以通过腺相关病毒传递,在体内的多种异种移植瘤模型中可见。总之,我们揭示了异常microRNA亚型在肿瘤中的广泛积累,并通过编辑和修复缺陷microRNA开发了一种植物rdr1介导的抗肿瘤策略。
癌症作为一种细胞异常增殖的疾病,是全球主要的公共卫生问题。癌症的诱因非常复杂,是胞内多种调控通路的突变和微环境共同作用的结果,其中微小RNA(miRNA)是近年来被认为与癌症发生息息相关的重要RNA分子。在哺乳动物中,具有2-nt 3' 末端悬垂的成熟miRNA双链可以被Argonaute(AGO)识别并装载形成RNA诱导的沉默复合体(RISC)进而调控靶基因的表达[1]。在癌症中,全局miRNA剂量减少被认为是癌症发生的诱因之一[2]。然而,迄今为止对于不同癌症中普遍miRNA缺乏的原因尚未被系统陈述。
细胞周期的过度激活是癌细胞异常增殖的必要条件,因此细胞周期基因是抗癌药物研发的重要靶点。现有细胞周期的药物往往只能针对一种或者几种靶点,因而无法克服基因冗余性而带来的耐药性[3]。有意思的是,许多miRNA都可以直接靶向并抑制细胞周期基因,从而直接控制细胞增殖[4]。因此,能否通过修复肿瘤中有缺陷的miRNA通路从而实现对于肿瘤细胞增殖的抑制,就一直是一个悬而未决的生物学问题。一旦成功,则可开发成为一种肿瘤治疗的新策略。
与miRNA不同,siRNA来源于不同RNA 依赖性RNA 聚合酶(RDR) 合成的双链RNA底物。有趣的是,RDR几乎在所有真核生物中都已被发现,但在进化过程中,其在具有次级免疫系统的脊椎动物中丢失。在植物中,依赖RDR1的siRNA尤其参与抗病毒免疫反应,是植物特有的、最核心的分子免疫反应通路之一[5]。近年来,跨物种生物工程已成功应用于基础研究和转化医学,例如来自细菌的Crispr-Cas。因此,我们尝试从动植物免疫系统的差异出发,在哺乳动物中进行基于植物RDR1的植物基因工程,并研究其相关的转化医学的应用。
2022年5月26日,北京大学杜鹏研究员课题组在Cell杂志在线发表了题为“A plant immune protein enables broad antitumor response by rescuing microRNA deficiency”的研究论文。该研究发现,在不同的人类原发性癌症样本和癌症细胞系中,不能有效结合AGO2复合体的3’末端短1-nt的miRNA异构体广泛积累。异位表达的植物免疫蛋白RDR1通过其单核苷酸加尾修饰这些AGO2游离出的miRNA双链异构体,以重新激活有缺陷的miRNA通路,从而特异性阻断实体瘤和白血病中癌细胞的细胞周期。

在本研究工作中,作者主要有以下发现:
1、RDR1蛋白通过靶向细胞周期广泛抑制癌细胞的增殖
为了在哺乳动物细胞中进行基于植物RDR1的生物工程,作者分别从拟南芥(At)和水稻(Os)中克隆RDR1基因到基于Dox诱导的慢病毒载体上。最终,本研究获得了13个稳定的RDR1诱导细胞系(包括7个实体瘤、3个白血病、3个非癌症细胞系)和2个RDR1恒定表达的胚胎干细胞系。通过Western blot和活细胞成像,作者验证了RDR1在哺乳动物细胞中成功实现了异位表达。
在接下来的研究中,令作者惊讶和意外的是,AtRDR1和OsRDR1能够在体外显著抑制所有10种癌症细胞系的增殖,但对其他5种非癌细胞没有影响(图1)。RDR1还可以显著抑制癌细胞的克隆形成能力。在分子水平上,基于RNA-seq的基因集富集分析(GSEA)表明,AtRDR1和OsRDR1可以干扰所有癌症细胞系中的细胞周期过程,但在非癌对照细胞中没有明显作用(图2)。值得注意的是,短时间(2-3天)诱导RDR1同样可显著抑制癌细胞中的细胞周期过程(图2),表明细胞周期通路可能是RDR1的直接作用靶点。随后,EdU/PI染色分析显示,RDR1在癌细胞中的表达显著降低了S期的细胞比例,反而增加了G0/G1期的细胞比例。因此,作者认为植物免疫蛋白RDR1是一种外源肿瘤抑制因子,它能够特异靶向并干扰癌细胞中的细胞周期过程,但在非癌症细胞中却不起作用。
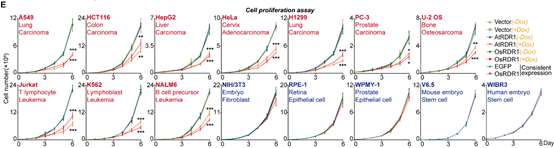
图1 AtRDR1和OsRDR1广谱且特异的抑制癌细胞增殖,但不影响非癌细胞系
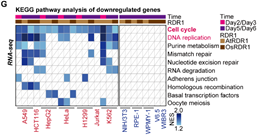
图2 RDR1能够特异靶向并干扰癌细胞的细胞周期,但对非癌细胞不起作用
2、在3’末端短1个碱基的受损的miRNA异构体在多种肿瘤中广泛积累
由于RDR1参与植物中的小RNA通路,作者在RDR1诱导表达前后的癌症和非癌症细胞中进行小RNA 测序。令人惊讶的是,作者发现诱导RDR1后的癌症细胞中miRNA的整体表达明显增加,但在非癌症细胞系中却没有出现这种现象。随后,作者还通过miRNA通路关键组分的敲低和AGO2-CLIP等实验,提出植物RDR1通过提高全局miRNA表达以特异挽救癌细胞中的miRNA缺乏来抑制细胞周期和增殖。
为了进一步研究RDR1特异靶向癌细胞的机制,作者对已公开发表的小RNA测序数据进行系统分析,包括TCGA数据库的9980组癌症病人数据以及GEO数据库的癌症病人、癌症细胞系以及正常组织的数据。结果表明,在很多癌症病人和细胞系的样本中,在3’末端短1-nt的miRNA异构体出现了大量的积累(图3)。这些3’末端短1-nt的miRNA在部分癌症样本中甚至成为不同miRNA异构体中数量最多的群体(图3)。由于AGO蛋白结构的特殊性,2-nt悬垂的结构有利于miRNA双链进入AGO2中形成RISC[6]。作者提出,这种1-nt悬垂的异构体,相比于2-nt悬垂的异构体进入AGO2的效率更低,并通过EMSA和MST实验进行了验证。同时,通过AGO2-IP的小RNA测序,作者进一步分析发现3’末端短1-nt的miRNA异构体在Input组更富集,进一步表现出短1-nt的miRNA异构体进入AGO2的效率更低。综上,作者提出,在癌细胞中,这种短1-nt的异常miRNA双链异构体不能有效地进入到AGO2中,并且不稳定,因此可能与不同肿瘤中的miRNA剂量减少有关。
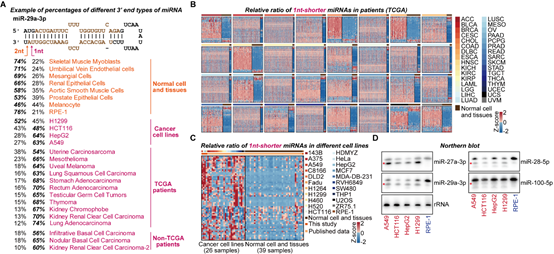
图3 异常的3’末端短1-nt的miRNA异构体在不同的人类肿瘤中广泛积累
3、RDR1通过单核苷酸加尾修复癌症中有问题的miRNA异构体
据报道,植物RDR6同时具有RNA聚合酶和核苷酸转移酶活性[7],而在后续的小RNA测序数据分析中,作者发现具有3’端单核苷酸加尾的成熟miRNA特异富集于RDR1异位表达的癌症细胞中。有趣的是,这种单核苷酸加尾主要出现在3’末端短1-nt的miRNA上,但很少出现在注释的切割末端上。随后作者在大肠杆菌中纯化出重组的rAtRDR1和酶活位点突变的3DA mutant rAtRDR1。通过体外生化实验,作者直接证明了rAtRDR1能够对单链miRNA和具有1-nt或2-nt悬垂的miRNA双链进行3’末端单核苷酸修饰,但不能修饰具有平末端的miRNA双链。
结合以上的发现,作者设想RDR1倾向于识别AGO2中游离出来的具有1-nt悬垂的miRNA双链作为底物,这些异构体尤其在癌症细胞中积累,但在非癌症细胞中不积累,并用单核苷酸加尾修饰这些有问题的miRNA。为了验证这一点,作者首先在表达RDR1的肺癌A549细胞中进行了AGO2敲低实验,随后进行小RNA序列分析。正如预期的那样,AGO2缺失确实进一步加强了RDR1介导的miRNA修饰,在癌细胞中短1-nt的miRNA异构体上单核苷酸加尾的比例大幅提高(图4)。之后,体外将rAGO2与具有1-nt/2-nt悬垂的miRNA双链预孵育后再加入rRDR1进行游离miRNA双链的加尾实验,结果显示与AGO2亲和力较低的1-nt悬垂的miRNA双链在与rAGO2蛋白预孵育后更倾向于被RDR1修饰(图5)。
最后,作者还通过给1-nt悬垂的miRNA双链加尾后的重新结合,1-nt/2-nt外源miR-34c双链的体外转染等实验和分析,共同证明了RDR1拥有核苷酸转移酶活性,能够对AGO2中游离出的短1-nt的miRNA双链异构体进行单核苷酸修饰,以恢复这些异构体对AGO2的装载效率,并最终修复癌症中有缺陷的miRNA通路。

图4 AGO2缺失可显著增强癌细胞中RDR1介导的miRNA加尾事件
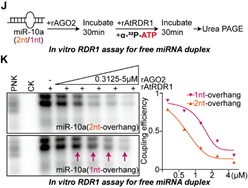
图5 RDR1更倾向于识别游离的具有1-nt悬垂的miRNA双链异构体作为底物
4、RDR1抑制多种小鼠实体瘤和白血病的进展
接下来,作者想在小鼠体内验证植物RDR1的抗肿瘤作用。首先,作者将RDR1诱导型癌症细胞系注射免疫缺陷小鼠以进行体内荷瘤实验,并且通过Dox喂水以实现RDR1的异位表达。结果表明,野生型而非突变型RDR1显著抑制了所成肿瘤的大小、体积和重量。作者还发现,在A549,H1299和PC-3细胞所成的荷瘤中,植物RDR1能够显著提高癌细胞中miRNA的表达,从而抑制了癌细胞的细胞周期。
类似的,作者还评估了RDR1在体内白血病小鼠模型中的抗肿瘤作用。与载体对照或突变的RDR1相比,野生型RDR1能够显著抑制三种白血病细胞系(Jurkat、K562和NALM6)在免疫缺陷小鼠外周血中的增殖,并最终延长异种移植小鼠的寿命。同样,RDR1可以在体内显著增加白血病细胞中的miRNA表达以抑制白血病细胞中的关键细胞周期组分,包括CDK1、CCNE2、PLK1、CDK6等,从而抑制细胞周期。
最后,通过纳米囊泡包装体外纯化的RDR1蛋白和AAV包装的RDR1,分别在体外细胞和体内实体瘤水平上实现了RDR1的直接递送和肿瘤抑制(图6)。
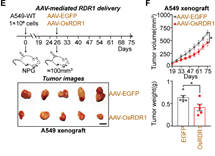
图6 AAV递送的RDR1抑制小鼠体内实体瘤生长
综上,此项研究首次揭示了在各种人类原发性肿瘤中广泛积累异常的3’末端短1-nt的miRNA异构体,这为理解肿瘤发生过程中全局miRNA剂量的减少提供了新的见解。利用植物免疫蛋白RDR1,我们通过挽救癌细胞中的miRNA缺陷来实现广谱的抗肿瘤反应,并开发了一种新的策略来编辑和操纵miRNA,使之成为对抗癌症等人类疾病的强大武器。
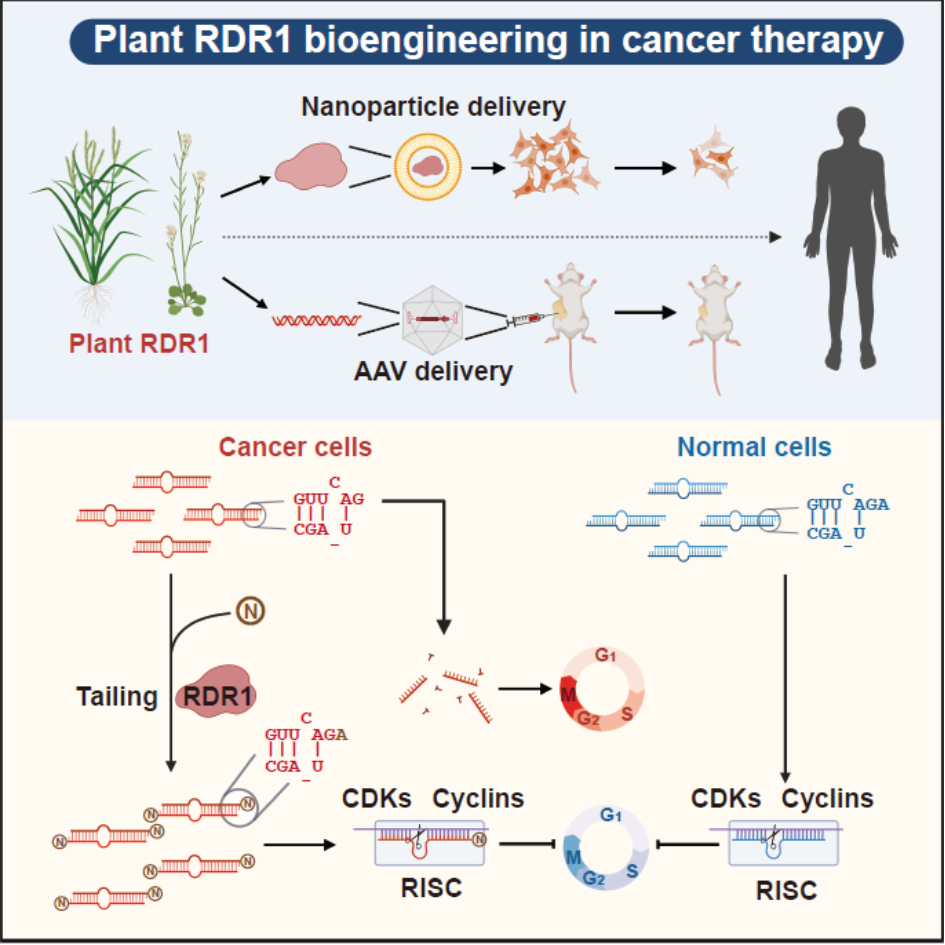
模式图表示植物RDR1 通过挽救癌症中的microRNA 缺陷来实现广谱的抗肿瘤反应
北京大学生命科学学院/北大-清华生命科学联合中心的杜鹏为该论文的通讯作者。北京大学前沿交叉学科研究院博士研究生齐烨和生命科学学院博士研究生丁力为本文的并列第一作者。北京大学前沿交叉学科研究院博士研究生张司文参与了部分工作,北京大学博士研究生姚升泽(已毕业)和博士后翁健莉也对本文有重要贡献。北京大学李毅和吴虹教授合作参与完成了这一工作,并给予了大力支持。该项目得到了国家自然科学基金、北京大学“细胞增殖与分化”教育部重点实验室、北大-清华生命科学联合中心和北大-启东创新基金的资助。
参考文献:
1、Bartel, D.P. (2018). Metazoan MicroRNAs. Cell 173, 20-51. 10.1016/j.cell.2018.03.006.
2、Lin, S., and Gregory, R.I. (2015). MicroRNA biogenesis pathways in cancer. Nat Rev Cancer 15, 321-333. 10.1038/nrc3932.
3、Otto, T., and Sicinski, P. (2017). Cell cycle proteins as promising targets in cancer therapy. Nat Rev Cancer 17, 93-115. 10.1038/nrc.2016.138.
4、Hydbring, P., Wang, Y., Fassl, A., Li, X., Matia, V., Otto, T., Choi, Y.J., Sweeney, K.E., Suski, J.M., Yin, H., et al. (2017). Cell-Cycle-Targeting MicroRNAs as Therapeutic Tools against Refractory Cancers. Cancer Cell 31, 576-590 e578. 10.1016/j.ccell.2017.03.004.
5、Cao, M., Du, P., Wang, X., Yu, Y.Q., Qiu, Y.H., Li, W., Gal-On, A., Zhou, C., Li, Y., and Ding, S.W. (2014). Virus infection triggers widespread silencing of host genes by a distinct class of endogenous siRNAs in Arabidopsis. Proc Natl Acad Sci U S A 111, 14613-14618. 10.1073/pnas.1407131111.
6、Ma, J.-B., Ye, K., and Patel, D.J. (2004). Structural basis for overhang-specific small interfering RNA recognition by the PAZ domain. Nature 429, 318-322.
7、Curaba, J., and Chen, X. (2008). Biochemical activities of Arabidopsis RNA-dependent RNA polymerase 6. J Biol Chem 283, 3059-3066. 10.1074/jbc.M708983200.