
-

生物通官微
陪你抓住生命科技
跳动的脉搏
首个肌肉萎缩症基因疗法6.22待审批,但它会奏效吗?
【字体: 大 中 小 】 时间:2023年06月07日 来源:nature
编辑推荐:
FDA的决定预计将于本月做出,这一决定经历了几次挫折和延误,将给患有杜氏肌营养不良症的儿童的家庭带来艰难的选择。
基因疗法治疗遗传性疾病的道路漫长而昂贵,但该领域可能很快就会有一些好消息。6月22日,美国食品和药物管理局将决定是否批准首个治疗杜氏肌营养不良症(DMD)的基因疗法,这是一种遗传性疾病,大约每3500名男孩中就有1人患病。患有DMD的儿童不能制造一种叫做dystrophin(肌养蛋白)的蛋白质,导致肌肉进行性退化,并在20多岁时因心脏或呼吸衰竭而死亡。
这种名为SRP-9001的疗法是由马萨诸塞州剑桥市的Sarepta治疗公司研制的。若是能够获批,这将是自2017年以来FDA批准的第13个基因疗法,也是第一个针对儿童普遍遗传疾病的基因疗法。加速批准将使这种药物在大规模临床试验完成之前进入市场,因为有证据表明,这种疗法可以让男孩产生一种基因工程版本的microdystrophin。
由于FDA官员和顾问对Sarepta迄今为止的数据说服力表示担忧,决定日期被推迟到5月底;SRP-9001似乎对肌肉功能只有适度的影响,而且只对某些人有影响。该公司的一份新闻稿称,该机构可能只批准该药物用于4岁和5岁的男孩,但如果一项正在进行的临床试验表明该药物的疗效值得与之相关的风险,该机构可能会扩大该范围。分析人士预测,这种一次性治疗将花费200万美元。Sarepta的一位发言人拒绝透露药物的价格标签,直到药物被批准,但表示它的定价将“低于它给患者带来的价值”。
尽管如此,一些科学家希望此次批准将为更多的基因疗法铺平道路。西雅图华盛顿大学的神经学家Jeffrey Chamberlain参与开发了Sarepta使用的一些技术,他说:“像这样的巨大成功将在很大程度上验证这项技术。”“这是我们现在迈出第一步,帮助孩子们的一种方式。”
DMD看起来是合适基因治疗的直接目标。这种疾病几乎只影响男孩,因为他们只有一个X染色体拷贝,而X染色体是dystrophin基因所在的位置;而通常情况下携带致病变异基因的女孩会有另一个备份而可以不受影响。在肌肉细胞中替换哪怕一部分有效的蛋白质,也应该能逆转这种疾病,或者至少能阻止它的发展。
但事实证明,开发这种替代品非常困难。dystrophin蛋白是人类基因组中最长的基因,它太大了,无法放入通常用于传递基因治疗的腺相关病毒(AAV)载体中。Sarepta和其他几家公司通过设计一种只编码蛋白质最重要部分的基因来解决这个问题(见下图)。由此产生的“微营养不良蛋白(microdystrophin)”只是部分有效。
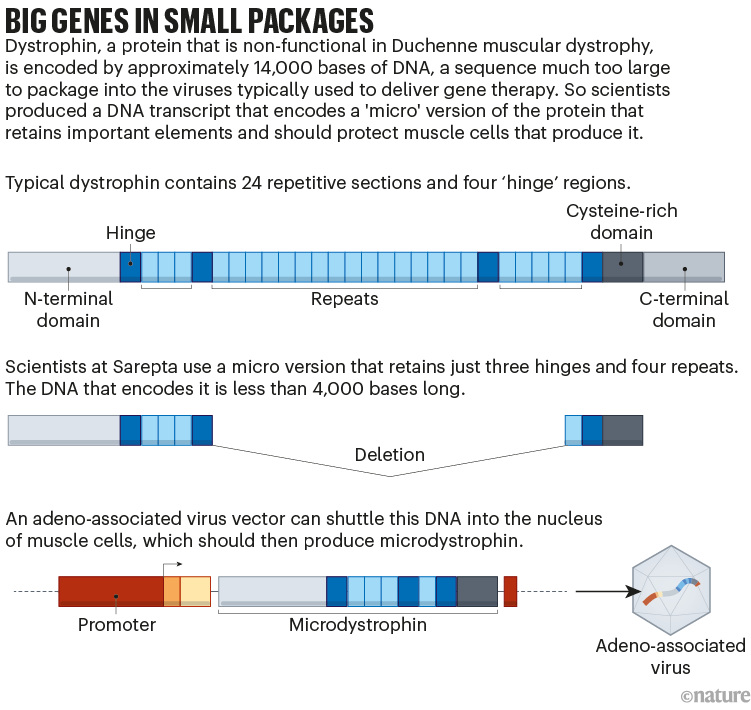
将基因注入足够多的细胞以产生影响也是一个挑战。肌肉占身体质量的30-40%,因此治疗DMD需要极高剂量的AAV载体。这增加了副作用的风险,包括器官损伤。而且因为肌肉细胞分裂频繁——尤其是在一个正在成长的孩子身上——体内基因的数量会随着时间的推移而被稀释。目前还不清楚这种疗法的效果能持续多久,尽管Sarepta从四个孩子身上获得的数据表明,这种临床改善可以在治疗后持续四年。
尽管大多数FDA批准要求药物通过两个III期安慰剂对照临床试验来测试治疗效果,但Sarepta正在寻求的加速审批途径允许公司依靠“替代终点”来证明其价值。这些措施显示了一种生物效应——在这种情况下,微营养不良蛋白(microdystrophin)水平很高——但不是症状的改善。
Sarepta的第一个大型III期试验仍在进行中,预计将于今年晚些时候公布数据。FDA转而对52名年龄在4至7岁的男孩进行了几项中期试验。结果显示,这些男孩的肌肉产生了微肌营养不良蛋白(microdystrophin),但在服用药物一年后,这些孩子的肌肉功能没有统计学上的显著改善。
据报道,FDA工作人员原本计划拒绝Sarepta的申请。但是FDA生物制品评估和研究中心(CBER)的主任Peter Marks介入了——在5月12日安排了一次与一个独立科学咨询委员会的公开会议,以权衡这种药物是否应该获得加速批准。该委员会以8票对6票的微弱优势建议批准该议案。虽然FDA不必听从委员会的建议,但它通常会听从。
咨询委员会评估了替代标记物的证据以及临床益处。一些投票赞成这种疗法的人说,由于DMD进展缓慢,可能很难在一年后确定药物的效果。但当Sarepta只观察32名接受SRP-9001或安慰剂治疗的6岁以下男孩时,接受治疗的男孩的肌肉功能得到了显著改善。
Sarepta的首席科学官Louise Rodino-Klapac认为,在研究开始时,安慰剂对照组中年龄较大的男孩比年龄较小的男孩更健康,这使得该组的药物效果相比之下显得更弱。Rodino-Klapac希望正在进行的III期试验能够更好地控制每个患者的初始状态,并表明它对年龄较大的男孩的肌肉同样有效。
年龄较小的男孩在统计学上的显著改善足以说服FDA顾问委员会成员Donald Kohn投票赞成这种药物,他在加州大学洛杉矶分校从事干细胞研究。“从数据的角度来看,(Sarepta)并没有为自己辩护,”但是,他补充说,对小男孩的疗效表明这种药物确实有效。“这是对希望的投票。”
其他人则更关心的是整体疗效的缺乏。“我理解‘有总比没有好’的吸引力,但问题是代价是什么,”巴尔的摩约翰霍普金斯大学(Johns Hopkins University)的流行病学家Caleb Alexander说,他也是委员会成员,并投票反对该药物。他说,不仅SRP-9001有明显的副作用,而且到目前为止完成的安慰剂对照试验也没有强有力地表明高水平的微肌营养不良蛋白有可以预期的临床结果。他说:“没有多少对男孩亚组的事后分析能改变这一事实。”
FDA和咨询委员会成员也对Sarepta是否会完成临床试验表示担忧,该试验仍在评估60多名最初接受安慰剂的男孩,现在正在接受该药。他们指出,该公司还没有完成此前FDA加速批准的三种DMD药物的试验。它们仍在市场上出售。Sarepta的一位发言人表示,这些试验现在已经招募了足够多的患者,目前正在进行中。
“这是一个非常复杂的决定。”芝加哥肌肉萎缩协会的首席研究官Sharon Hesterlee说。虽然她同意这种疗法的效果可能是有限的,而且有很大的风险,但“什么都不做的风险是100%致命的”。
将microdystrophin基因植入肌肉所需的大量AAV不仅有风险,microdystrophin基因本身似乎还会对一些儿童产生严重的副作用。FDA暂停了多项DMD基因治疗试验,原因是由于污染问题和有患者病情加重。2021年,FDA暂时停止了辉瑞公司(Pfizer)的一项测试自有版本microdystrophin的研究,主要原因是其中一名患者死亡。
为了调查这个问题,辉瑞、Sarepta和Solid Biosciences公司(总部位于马萨诸塞州查尔斯顿)决定将他们的microdystrophin数据集中起来。他们的研究很快将发表在《新英格兰医学杂志》(New England Journal of Medicine)上。研究发现,肌营养不良蛋白基因的某些突变会导致免疫系统将microdystrophin识别为外来入侵者,并对其进行攻击,从而导致肌肉和心脏出现危险的炎症。两家公司开始对临床试验参与者进行基因筛选,排除那些有相关突变的人——在Sarepta的案例中,只有不到5%的突变——这就暂时解决了这个问题。但是参与这项研究的马里兰州贝塞斯达国家神经疾病和中风研究所的神经学家Carsten Bennemann,说,基因疗法最终必须量身定制,以帮助这些患者。
尽管如此,Hesterlee指出,即使是那些有资格接受Sarepta新批准的治疗的人,也面临着艰难的选择。AAV基因治疗在人的一生中只能进行一次:一旦免疫系统遇到病毒载体,它很可能在未来攻击它。由于AAV是大多数基因疗法的载体选择,患有DMD的孩子的父母可能不得不选择是现在用唯一批准的疗法来治疗他们的孩子,还是等待Sarepta或其他公司在未来发布更好的疗法——这意味着让疾病继续发展,让患病男孩失去更多的肌肉功能。Hesterlee说:“对家庭来说,几个月的时间可能很长。
辉瑞公司正在对99名男孩进行三期试验,在类似的AAV载体上使用他们的microdystrophin,并预计明年公布初步结果。其他几家公司也在开发自己的microdystrophin,包括马里兰州罗克维尔的Regenxbio公司,该公司今年早些时候启动了一项小型试验。
其他人正在寻找改进携带该基因的病毒载体的方法。2022年,Solid Biosciences停止了其microdystrophin的二期试验,转而使用一种专门针对肌肉细胞的不同载体,并且可能以更低的剂量给药。该公司计划在今年晚些时候开始给患者用药。在今年5月于洛杉矶举行的美国基因与细胞治疗学会年会上,他们展示了一种新系统,该系统涉及几个AAV载体,每个载体都携带一部分肌营养不良蛋白基因。然后,这些基因产物可以连接在一起,形成一种比单个载体所能携带的大得多的肌营养不良蛋白。进一步的方法是将编码CRISPR/Cas9基因组编辑系统的基因注入患者,目的是永久改变肌肉细胞中的肌营养不良蛋白基因本身。
还有其他研究人员正在寻找替代载体,包括脂质胶囊、纳米颗粒、携带肌营养不良蛋白基因到肌肉细胞的抗体,以及整合到患者基因组中的病毒。至少在理论上,这些治疗方法可以用于已经接受过AAV基因治疗的人。
但现在如果有了一种被批准的疗法,尝试测试自己疗法的公司可能会发现招募试验参与者变得更加困难,因为他们可能不想冒险服用安慰剂。此外,康涅狄格州纽黑文耶鲁大学的健康服务研究员Reshma Ramachandran担心,如果公司知道他们可以让microdystrophin疗法获得批准,他们将更有可能开发自己的稍微调整的版本,而不是花更长的时间开发自己的创新方法。
基因疗法的发展一直是一项风险和昂贵的业务,最近的经济衰退使许多生物技术公司倒闭。尽管如此,自2017年首个用于白血病的基因疗法Kymriah获批以来,FDA批准的基因疗法数量每年都在增加。
然而,DMD基因疗法的批准仍将是一个里程碑。到目前为止,大多数被批准的基因疗法都是针对癌症、极其罕见的疾病和视网膜疾病等疾病,这些疾病很容易被病毒靶向。西雅图华盛顿大学的神经学家Jeffrey Chamberlain说,DMD是不同的,无论是研究人员必须解决的技术挑战数量,还是该疗法可以服务的大量患者。该机构目前正准备在今年考虑十几种基因和细胞疗法,包括两种治疗镰状细胞病的疗法,这是一种比DMD更普遍的遗传病。
FDA似乎正在优先考虑这些方法。在最近的谈话中,CBER主任Marks表示,该机构计划加速基因疗法的审批途径,包括更广泛地使用替代终点。他在1月份肌肉萎缩协会(Muscular Dystrophy Association)年会上的一次演讲中说:“我们不能过于谨慎地审批加速审批,以至于我们阻止了可能挽救生命的疗法及时进入市场。”
这让一些科学家感到担忧,他们担心患者最终会为无效药物支付高昂的价格。“我确实认为,监管灵活性的概念可能会被扭曲,”Alexander说。Ramachandran指出,FDA于2021年加速批准了一种阿尔茨海默病药物aducanumab,该药物成功地消除了患者大脑中的淀粉样斑块,但并没有明显改善他们的健康状况。FDA随后批准了另一种类似的药物,但只显示出轻微的临床效果。“杜氏症患者不仅应该有更多的选择,他们需要更好的选择,”Ramachandran说。
但Chamberlain认为,即使是一小部分的成功也会对整个领域有所帮助。“还有很大的改进空间,我认为这将为我们争取一些时间来进行这些改进。”
编译:vivian
 生物通微信公众号
生物通微信公众号
知名企业招聘