
-

生物通官微
陪你抓住生命科技
跳动的脉搏
核角蛋白6A通过TEAD1互作上调HPV致癌基因表达的机制研究及其在宫颈癌发生中的意义
【字体: 大 中 小 】 时间:2025年06月22日 来源:Virology Journal 4
编辑推荐:
本研究揭示了核定位的角蛋白6A(K6A)通过转录因子TEAD1调控HPV16致癌基因E6/E7表达的新机制。研究人员通过RNA干扰、染色质免疫沉淀等技术发现,K6A依赖其N端核定位信号进入细胞核,与TEAD1形成复合物结合HPV长控制区(LCR),显著促进宫颈癌细胞增殖。该发现为HPV相关癌症的靶向治疗提供了新思路。
研究背景与意义
人乳头瘤病毒(HPV)是宫颈癌的主要致病因子,其致癌基因E6/E7通过降解抑癌蛋白p53和pRb驱动肿瘤发生。尽管已知病毒长控制区(LCR)调控E6/E7表达,但宿主因子如何精细调控这一过程仍是未解之谜。近年研究发现,传统认为仅存在于细胞质的角蛋白家族成员(如K17)可核转位参与基因调控,这为理解HPV致癌机制提供了新视角。
在此背景下,日本国立传染病研究所的Tomoya Miyamura、Seiichiro Mori*团队在《Virology Journal》发表研究,首次揭示应激响应蛋白角蛋白6A(K6A)通过TEAD1依赖性机制激活HPV16致癌基因表达。该发现不仅拓展了对核角蛋白功能的认识,更为HPV相关癌症的精准干预提供了潜在靶点。
关键技术方法
研究采用HPV16阳性宫颈癌细胞系(CaSki/SiHa),通过siRNA/shRNA敲降K6A和TEAD1,结合荧光报告基因验证LCR活性;利用细胞分馏和免疫印迹分析K6A核定位;通过染色质免疫沉淀(ChIP)和免疫共沉淀(Co-IP)证实K6A-TEAD1-LCR三元复合物的形成;采用Fluoppi活细胞成像系统可视化核内蛋白互作。
研究结果
1. 角蛋白家族参与HPV致癌基因调控
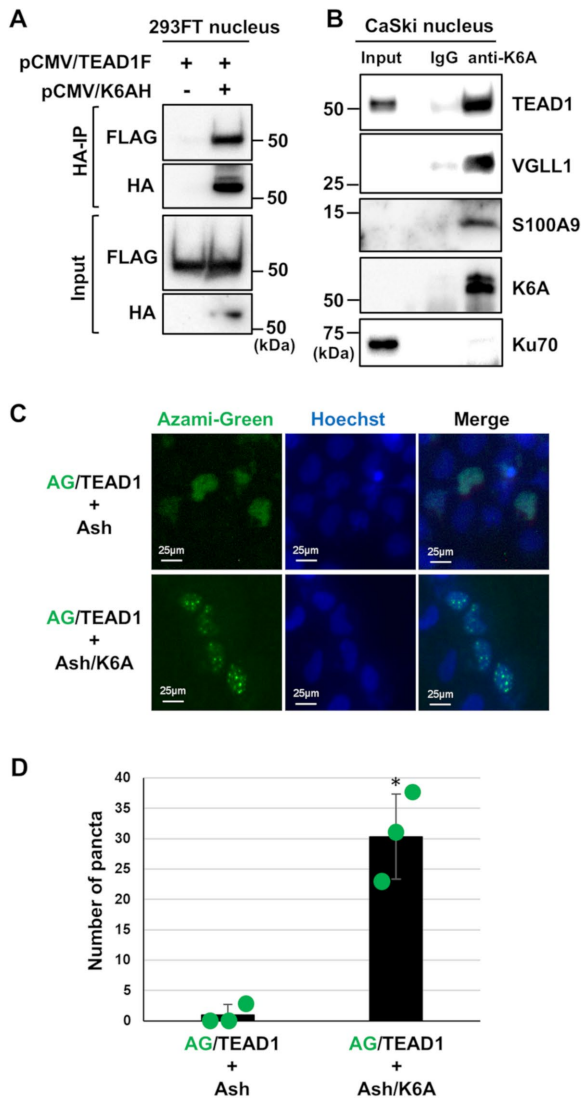
通过系统性筛选9种LCR结合角蛋白,发现K6A敲降使HPV16 E6*I mRNA水平降低约60%,效果与TEAD1敲降相当。双敲实验显示K6A与TEAD1作用于同一通路,而荧光素酶报告实验证实K6A直接增强LCR转录活性。
2. K6A正向调控E7表达并促进癌细胞增殖
稳定敲低K6A使CaSki细胞E7蛋白水平下降50%,细胞增殖速率显著减缓。通过构建shRNA抗性突变体回补K6A后,E7表达得以恢复,且该过程依赖TEAD1,证实K6A-TEAD1轴对维持致癌基因表达的必要性。

3. K6A具有功能性核定位信号
细胞分馏实验首次证实内源性K6A存在于核内,其N端9-44位氨基酸构成进化保守的双分型核定位信号(NLS)。删除该NLS(ΔNK6A)使核定位效率降低70%,且回补ΔNK6A仅能部分恢复E7表达,说明核转位是K6A调控功能的关键。
4. 核K6A通过TEAD1锚定至HPV LCR
ChIP实验显示K6A特异性富集于HPV16 LCR区域,而TEAD1/3/4联合敲降使结合量减少40%。Co-IP与Fluoppi实验证实K6A与TEAD1及其共激活因子(VGLL1/S100A9)在核内形成复合物,荧光斑点定量分析显示共转染Ash/K6A与AG/TEAD1使核内荧光聚集体数量增加3倍。
结论与展望
该研究首次阐明核K6A作为TEAD1的转录共激活因子,通过形成"K6A-TEAD1-共激活因子"三元复合物强化HPV LCR超级增强子活性,从而维持致癌基因持续表达的分子机制。特别值得注意的是,K6A与炎症标志物S100A9的协同作用可能解释HPV感染背景下炎症促进癌变的临床现象。
从转化医学角度看,由于K6A在病变组织中高表达而在正常组织受限,其核定位机制和蛋白互作界面可作为药物设计的靶点。未来研究需在类器官模型和临床样本中验证该通路的普适性,并探索针对K6A核转位的小分子抑制剂在HPV相关癌症治疗中的应用潜力。
 生物通微信公众号
生物通微信公众号
知名企业招聘