
-

生物通官微
陪你抓住生命科技
跳动的脉搏
高分辨率成像质谱流式技术实现亚细胞结构精准定位
《Nature Methods》:High-resolution imaging mass cytometry to map subcellular structures
【字体: 大 中 小 】 时间:2025年10月31日 来源:Nature Methods 32.1
编辑推荐:
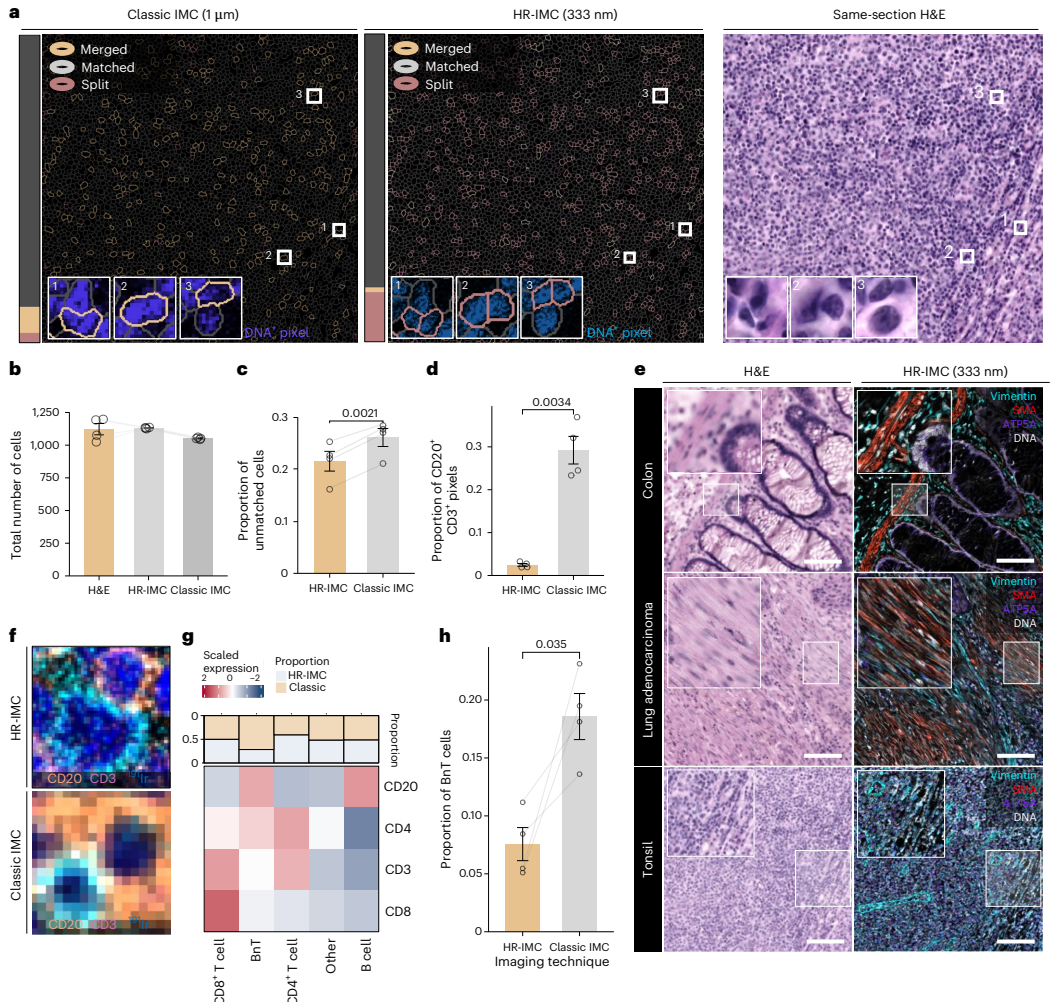
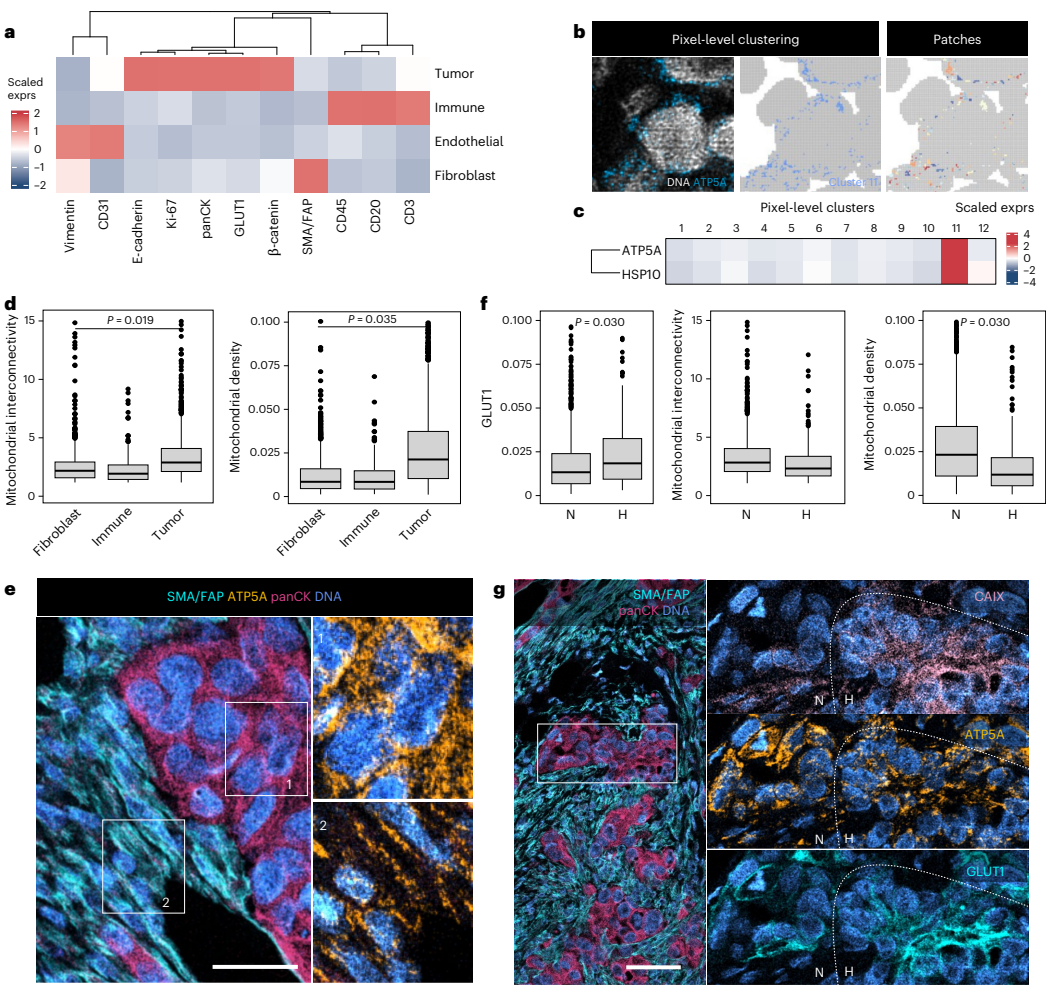
本研究针对传统成像质谱流式技术空间分辨率不足(1μm)的瓶颈,开发了高分辨率成像质谱流式技术。通过过采样结合点扩散函数反卷积,将分辨率提升至350 nm以下,首次实现了线粒体网络、核仁等亚细胞结构的可视化,并应用于卵巢癌细胞化疗扰动研究,为多组学空间生物学研究提供了突破性工具。


 生物通微信公众号
生物通微信公众号
知名企业招聘