免疫治疗为肿瘤治疗带来革命。目前,主流的免疫治疗是促进T细胞对癌细胞的细胞毒性作用,诱导免疫细胞吞噬癌细胞成为下一代免疫治疗的重要思路。许多治疗性单克隆抗体能诱导巨噬细胞吞食癌细胞(1),其作用机制主要是两种:1. Fcγ受体介导的吞噬,称为抗体依赖细胞吞噬效应(ADCP),典型是临床常用的赫赛汀和美罗华(2)。2. 阻断”别吃我”信号,例如具有前景的CD47单抗(3)。但在实际治疗中,抗体诱导的肿瘤吞噬效果并不明显,尤其是在实体瘤。因此,阐明巨噬细胞如何有效地吞食癌细胞对设计下一代肿瘤免疫治疗有重要意义。
2022年4月28日,中山大学苏士成团队在Nature Cancer杂志在线发表题为Macrophage mitochondrial fission improves cancer cell phagocytosis induced by therapeutic antibodies and is impaired by glutamine competition的研究成果,发现线粒体分裂通过改变吞噬机器两个重要成分WIP和WASP相变,从而促进巨噬细胞吞食癌细胞。靶向调控肿瘤微环境谷氨酰胺竞争的酶,能通过促进肿瘤吞噬从而提高多个单抗的疗效。
线粒体为免疫反应提供能量(4)。作者前期发现线粒体基因组转录的环形RNA通过调控ROS调控成纤维细胞功能(Bioart:Cell 苏士成/高志良/许小丁合作揭示线粒体定位circRNA调控肝脏免疫代谢性炎症机制)(5)。因此作者思考线粒体的动态变化是否会调控巨噬细胞吞食癌细胞。作者利用赫赛汀、美罗华、CD47单抗等三种治疗性抗体,使用乳腺癌、结肠癌、B细胞淋巴瘤三种不同的癌种共18株细胞与人原代巨噬细胞共培养,发现有效吞噬肿瘤的巨噬细胞线粒体呈颗粒样的分裂状态,并且线粒体分裂调控蛋白Drp1明显升高。体外基因敲除或药物抑制巨噬细胞线粒体分裂能明显抑制其对肿瘤细胞的吞噬。野生型巨噬细胞过继性注入无巨噬细胞的Csf1op/op肿瘤负荷小鼠中明显促进抗体介导下的巨噬细胞对肿瘤的吞噬和治疗效果,但敲除Drp1之后的巨噬细胞却没有这种能力。以上体内外实验证实线粒体分裂是巨噬细胞有效吞噬肿瘤细胞的必要条件(图1)。
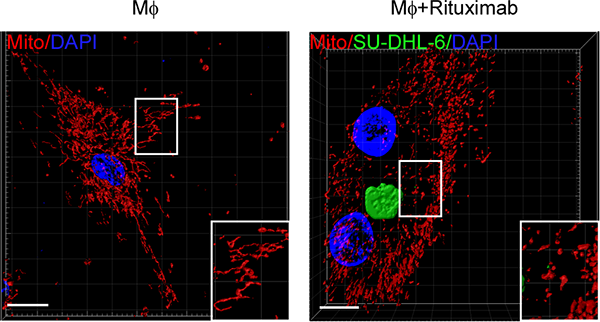
图1:线粒体分裂促进巨噬细胞吞噬肿瘤
Actin极化是巨噬细胞吞噬大颗粒物质时吞噬机器组装的主要步骤(6),作者发现线粒体分裂受到抑制后actin极化发生障碍。多项研究表明,胞内蛋白的聚集(液-液相分离)可调控多种细胞的功能(7,8)。作者首先通过IUPred2A网站进行蛋白结构分析,发现吞噬机器的两个重要成分WIP和WASP含有长片段的无序区,提示具有容易形成相变的结构。作者通过体外液滴形成、漂白实验和荧光共定位实验中证明WIP和WASP能形成明显的液滴。为了探索线粒体分裂与WIP/WASP相分离调控的具体机制,作者检测了线粒体分裂时的产物在巨噬细胞吞噬肿瘤细胞时的变化以及对WIP/WASP相分离的影响。结果显示,WIP/WASP液滴的形成被线粒体分裂后导致的胞内钙离子水平升高所抑制。在进一步的体外实验中,作者发现静息状态下WIP/WASP相分离阻止了PKC-θ磷酸化WIP,而线粒体分裂产生的胞内高钙离子水平抑制WIP/WASP液滴的形成,使PKC-θ容易接触并磷酸化WIP,从而增加巨噬细胞actin极化和对肿瘤细胞的吞噬。
为了探索肿瘤细胞耐受抗体介导的吞噬是否与巨噬细胞线粒体分裂有关,作者通过芯片、Western blot、质谱技术和Ocomine数据库检测对促吞噬抗体耐受和敏感肿瘤细胞株中差异蛋白的表达,发现耐受吞噬的肿瘤细胞高表达己糖激酶途径的关键酶GFPT2,且细胞内明显积聚其下游代谢产物。GFPT2是调控谷氨酰胺分解为谷氨酸盐的一个限速酶,能促进谷氨酰胺的消耗,而谷氨酰胺的消耗可抑制线粒体的分裂(9)。作者通过抑制肿瘤细胞GFPT2或添加GFPT2底物谷氨酰胺,发现能增加巨噬细胞线粒体的分裂和对耐受肿瘤细胞的吞噬,而去除微环境中的谷氨酰胺抑制了敏感肿瘤细胞的吞噬。通过基因敲除和化学抑制GFPT2酶均能提高临床单抗在肿瘤治疗中的效果。
总的来说,本研究通过对不同抗体介导的肿瘤吞噬模型的研究,揭示了肿瘤微环境谷氨酰胺的竞争抑制巨噬细胞内线粒体分裂和维持WIP/WASP相分离,从而抑制PKC-θ磷酸化WIP和Actin的极化,最终产生临床抗体耐药。该研究为增强下一代肿瘤免疫治疗效果提供了新的思路。
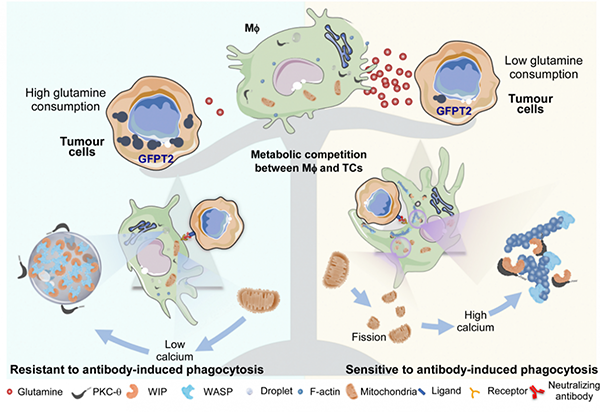
图2:该课题的主要机制示意图
苏士成教授为该文的通讯作者,博士后黎江、博士研究生叶盈盈、刘志瀚和张国杨医生为该论文的共同第一作者。蔡清清教授、马丽萍教授、冯茹教授为本课题提供了大力支持和帮助。

