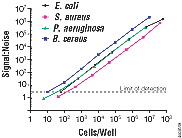
图2. 细菌细胞数与生物发光信号相关。将四种菌株Escherichia
coli(ATCC25922), Staphylococcus aureus(ATCC25923),
Pseudomonas aeruginosa(ATCC27853)及 Bacillus cereus(ATCC10987)在Mueller
Hinton II ( (参见技术手册#TB337中推荐的生长培养基) 中37°C培养过夜。过夜培养物用新鲜的MH
II Broth稀释50倍,然后继续培养数小时至对数期。在96孔板中,用MH II Broth系列稀释培养物样品。按照技术手册#TB337中所述方法进行检测。混合后的BacTiter-Glo™
试剂于室温平衡1.5小时以提高灵敏度。用Veritas™微孔板发光光度计(Cat.# E6501)记录生物发光。信号值为每次测量的三次重复的平均值。细菌细胞数用LB琼脂板上形成的克隆记数确定。
信噪比的计算为: S:N = [信号平均值-背景平均值/背景的标准差]。本实验对于E. coli,
S. aureus, P. aeruginosa 及B. cereusare的检测极限分别约为:40,
150, 70 及 10 个细胞。
最少可以检测10个细胞
BacTiter-Glo™微生物活细胞检测灵敏并呈线形(图2)。图2中的数据表明本检测最少可以检测到10个Bacillus
cereus细胞,它给出的信号水平大于无细胞的培养基背景信号3个标准差。发光信号与细胞数相关性良好,具有出色的线形关系及超过5个对数值的典型动态范围。BacTiter-Glo™检测的广泛的灵敏度及动态范围可以使用户在培养后立即监测E.
coli的生长(参见新产品章节)。
稳定的信号使应用更灵活
根据微生物及培养基,BacTiter-Glo™微生物活细胞检测产生的辉光型生物发光信号一般具有30分钟以上的半衰期(图3)。高灵敏度及信号稳定性使得BacTiter-Glo™检测非常适合于高通量筛选。这反映了其优良的Z'因子值。(Z'因子是根据动态范围及数据的变化来衡量检测的质量5)。对于96孔板及384孔板,BacTiter-Glo™检测的Z'因子分别为0.9和0.87。
与典型培养基及溶剂一同使用
萤光素酶反应的化学环境将影响酶的速率进而影响生
|
|
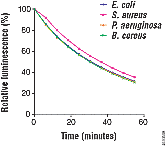
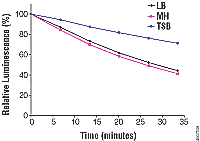
图 3. BacTiter-Glo™ 检测 产生辉光型生物发光信号。
如图2所述方法培养细菌细胞并检测。每次检测大约使用106个细胞。随时监测生物发光信号的稳定性。用Veritas™微孔板发光光度计(Cat.#
E6501)记录生物发光。 图 A. 将四种不同细菌: E. coli, S. aureus, P.
aeruginosa 及B. cereuswere 培养于Mueller Hinton II Broth
并检测。 图 B. 将E. coli 细胞培养于三种培养基: Luria-Bertani (LB),
Mueller Hinton II Broth (MH) 及Trypticase Soy Broth
(TSB), 并检测。
物发光强度及其动力学。已经证实BacTiter-Glo™检测与
典型的微生物生长培养基及常用的有机溶剂兼容(图4)。一般而言,我们推荐阳离子调整的Mueller Hinton
broth (MH II Broth, BD Cat.#297963)。它支持最常见的好氧菌及兼性厌氧菌的生长,被食品与药品局(FDA)及临床实验室标准的国家委员会(NCCLS)选择用于食品检测及抗微生物可疑性检测(6,
7)。在我们的实验中,这种培养基具有低生物发光背景和良好的批次重复性。DMSO通常用做溶解有机化学试剂的溶剂,当终浓度为3%时对生物发光信号几乎没有影响。
检测多种微生物
我们已经证明,使用BacTiter-Glo™检测法可以定性及定量检测列于表一中的多种微生物。这些微生物包括革兰氏阳性及革兰氏阴性菌,酵母及真菌。它们包括一些常见的抗微生物药物开发感兴趣病原体,生物防范方面感兴趣的生物威胁病原体,典型的微生物及一些随机种类。 |