
-

生物通官微
陪你抓住生命科技
跳动的脉搏
癌细胞真的会被饿死吗?
【字体: 大 中 小 】 时间:2023年02月20日 来源:Natue
癌细胞真的会被饿死吗?普林斯顿研究人员在Nature发文,发现肿瘤代谢比预期慢!
为什么肿瘤细胞会疯狂而迅速地扩张?是因为新陈代谢与正常细胞不同吗?
早在1925年,科学家Otto Heinrich Warburg就发现大多数肿瘤细胞依靠有氧糖酵解为自身代谢提供能量(Warburg效应),而正常分化的细胞主要依靠线粒体氧化磷酸化(TCA循环)或厌氧糖酵解为细胞提供能量。然而,癌症肿瘤细胞在哺乳动物体内生长需要消耗多少能量一直困扰着科学家。他们假设,肿瘤需要能量,可以快速代谢营养物质,使心脏、肝脏和胰腺等健康组织在代谢营养物质方面处于不利地位。但在《自然》杂志上发表的一项新研究中,来自普林斯顿化学和路德维希普林斯顿分校的Joshua Rabinowitz研究团队首次证明了事实恰恰相反:肿瘤将营养物质转化为可用物质。利用细胞能量的过程非常缓慢。这种减缓可能有助于肿瘤保存能量以完成增殖和在更大范围内扩散等任务。

使用同位素示踪剂输注、质谱(MS)和由此产生的代谢物标记数据的定量建模,他们开发并验证了一种测量小鼠组织和肿瘤中TCA循环通量的策略。用2-脱氧葡萄糖输注定量葡萄糖使用通量。
上述方法表明,健康小鼠的组织至少90%的ATP是通过TCA循环和氧化磷酸化产生的。而原发性实体瘤对TCA有明显的抑制作用,但仍通过氧化产生大部分ATP,说明实体瘤的ATP总生成率远低于健康器官。
首先,研究人员建立了小鼠组织能量代谢的系统级图谱。根据代谢通量等于分子通过代谢途径的周转率的定义,TCA通量是引入标记底物后标记部分的初始上升速率与TCA途径中代谢物的总和的乘积。那么,应该选择哪种代谢物进行标记呢?在不同的组织中,乳酸是TCA循环的主要燃料,可以迅速进入组织。因此,通过静脉注射[U-13C]标记的乳酸盐并在不同时间点测量,TCA代谢物被标记的速率可以反映TCA通量。
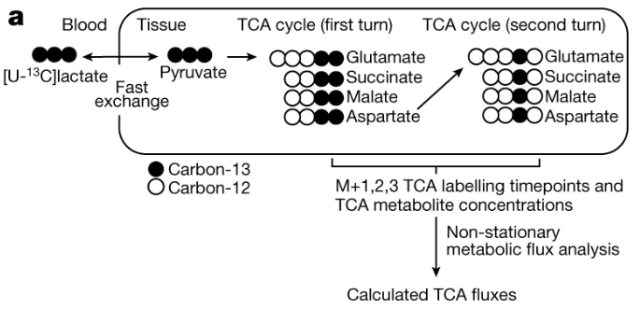
图例:TCA通量测量方法流程图【1】
研究人员将TCA通量测量应用于小鼠的几种癌症模型,发现肿瘤的TCA通量低于健康组织。在5个原发实体瘤模型中,注射[U-13C]乳酸或[U-13C]谷氨酰胺测量的TCA通量低于几乎所有健康组织。例如,在转基因小鼠(Kras突变和Trp53缺陷)胰腺肿瘤模型(GEMM PDAC)和皮下植入胰腺肿瘤小鼠模型(侧腹PDAC)中,TCA的流量比健康胰腺慢6倍。肺癌模型和结肠癌模型也有相似的结果。与实体瘤中较低的TCA通量相反,notch1驱动的t细胞急性淋巴细胞白血病可移植小鼠模型显示,与健康小鼠脾脏相比,TCA通量约高3倍。因此,与健康组织相比,小鼠的原发性实体肿瘤(不包括白血病)具有较低的TCA通量。这一结果与Warburg效应一致。
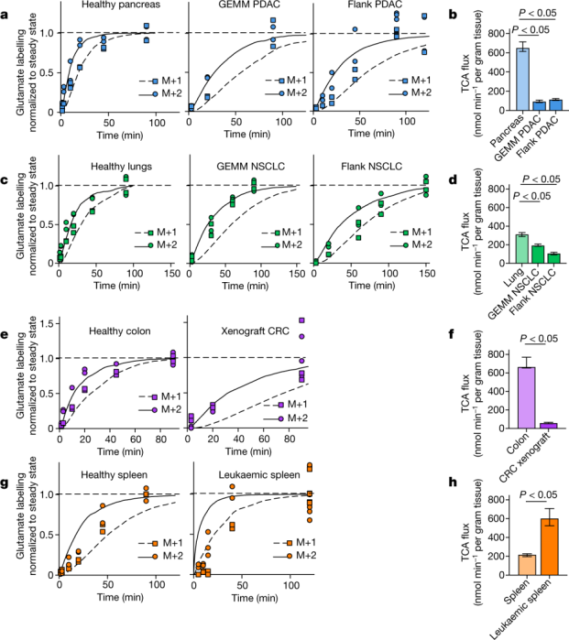
图示:健康小鼠组织与胰腺癌、肺癌、结肠癌、t细胞急性淋巴细胞白血病小鼠模型中TCA通量的比较【1】
转移的TCA通量如何?肿瘤转移需要癌细胞从组织中迁移出来,在血液或淋巴中存活,并建立新的组织生态位。先前的研究表明,转移性癌细胞具有较高水平的活性氧(ROS),这可能源于电子传递链。为了测量小鼠转移瘤中的TCA通量,研究人员使用两个转移到肺的原位乳腺癌异种移植小鼠模型进行了实验。他们发现,在这两种模型中,转移定植肺与原发肿瘤和周围健康肺组织相比,有更高的TCA通量。
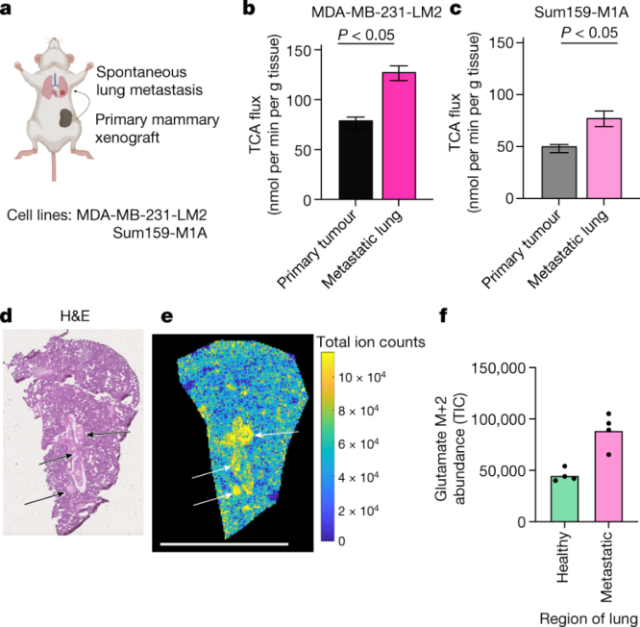
肺转移灶TCA通量高于原发灶【1】
尽管实体瘤的TCA通量比健康组织低,但它们可能通过高水平的糖酵解来补偿以达到高水平的生产。为了精确测量细胞葡萄糖通量,研究人员给小鼠注射了[1-13C]标记的2-脱氧葡萄糖。2-脱氧葡萄糖可以通过葡萄糖转运蛋白进入细胞并被磷酸化,但不能进一步代谢。
利用葡萄糖通量和TCA通量的数据,研究人员计算出ATP合成的总体速率。他们发现,在胰腺癌、肺癌和结肠癌的实体瘤模型中,小鼠的原发性实体瘤产生ATP的速度比相应的健康组织慢。进一步的研究发现,肿瘤比健康组织从糖酵解中获得更高比例的ATP。但尽管如此,大多数ATP是通过在每种组织和肿瘤类型中氧化产生的。
因此,小鼠体内的实体肿瘤比大多数健康组织更慢地产生和利用ATP,这与肿瘤通常是高代谢的概念相反。然而,这种方法不能区分肿瘤是否由于低代谢需求而产生ATP缓慢或低ATP生产能力(例如,由于有限的营养可用性)。
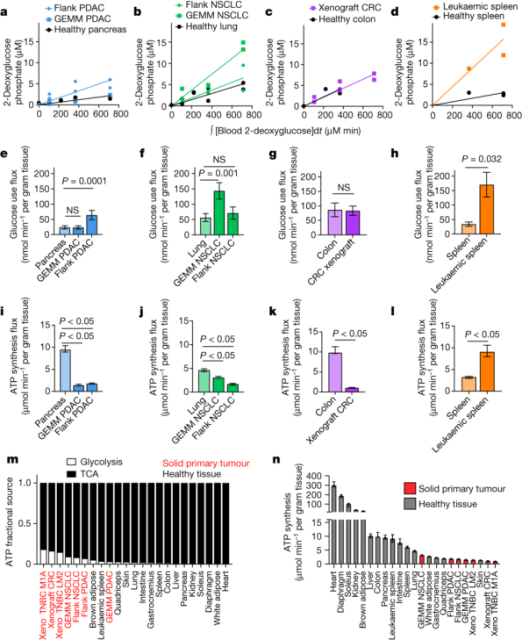
肿瘤组织合成ATP比健康组织快【1】
肿瘤如何在利用较少ATP的情况下扩张?研究人员进一步研究了ATP消耗的主要功能通路,包括胰腺中的酶分泌和脂肪消化,肾脏中的碳酸氢盐和钠循环,以及肝脏中的糖异生和糖原代谢。他们发现,与健康组织相比,肿瘤中这些途径的基因表达显著下调。在肝脏和肾脏中,这些基因的低表达可能导致编码的酶和离子泵消耗更少的ATP;而在胰腺中,ATP的保留是通过减少外分泌酶的合成而发生的。这些数据表明,实体瘤下调了组织特异性ATP消耗功能,从而节省了ATP消耗来支持增殖。
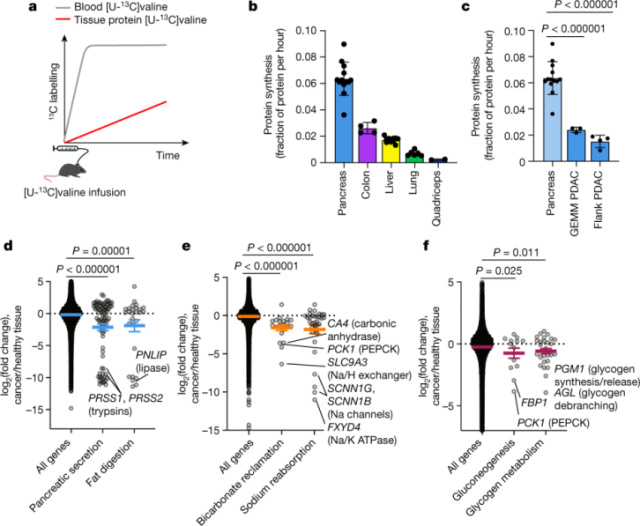
肿瘤下调ATP消耗组织活动【1】
总的来说,在五种不同类型的癌症中,研究小组发现肿瘤在低能量预算下成功增殖,部分原因是它们忽略了健康器官为整个身体的利益而执行的正常组织功能。“肿瘤面临着恶劣的代谢环境,它们没有允许身体其他部分发育的血管。所以他们被迫用更少的钱来凑合。”
这一发现对抗癌策略具有重大意义,因为它将我们的注意力引向了减缓能量代谢。一些针对癌症患者的治疗方案围绕着“饥饿疗法”“饥饿肿瘤”策略展开,假设肿瘤没有营养就不能生长,这在现在看来是值得怀疑的。因为随着实体瘤的进展,在ATP能量产生有限的情况下,仍然可以促进癌细胞不受控制的生长。
参考文献:【1】Bartman, CR, Weilandt, DR, Shen, Y. et al. Slow TCA flux and ATP production in primary solid tumors but not metastases. Nature (2023). https://doi.org/10.1038/s41586-022 -05661-6
Can cancer cells really be starved to death?