
-

生物通官微
陪你抓住生命科技
跳动的脉搏
条形码标记HIV-1揭示病毒持久性新机制:克隆增殖驱动的病毒库动态与表观遗传特征
【字体: 大 中 小 】 时间:2025年02月15日 来源:Nature Communications
编辑推荐:
本研究通过构建带条形码标记的R5嗜性HIV-1病毒株(NFNSX-BC),结合高通量测序技术(BI-seq)在人类化小鼠模型中系统解析了病毒库的动态变化。研究发现增殖性细胞克隆通过表观遗传激活特征维持病毒持久性,揭示了病毒反弹与克隆增殖的关联机制,为HIV功能性治愈策略提供了新靶点。
在艾滋病治疗领域,抗逆转录病毒治疗(ART)虽能有效控制HIV-1病毒复制,但潜伏的病毒库仍是实现治愈的主要障碍。这些整合在宿主基因组中的前病毒(provirus)如同定时炸弹,一旦治疗中断就会引发病毒反弹。更棘手的是,携带前病毒的细胞克隆还能通过增殖扩大病毒库规模,但驱动这种克隆增殖的分子机制及其对病毒持久性的贡献始终是未解之谜。
加州大学洛杉矶分校(UCLA)的研究团队在《Nature Communications》发表创新性研究,通过构建带有21bp独特条形码(barcode)的R5嗜性HIV-1病毒株NFNSX-BC,结合自主研发的条形码-整合位点同步测序技术(BI-seq),在人类化BLT TKO小鼠模型中首次实现了对病毒RNA谱系、前病毒DNA克隆及其整合位点的单分子水平多维追踪。这项研究揭示了增殖性细胞克隆通过独特的表观遗传特征逃避免疫清除,成为病毒持久性的"罪魁祸首"。
研究采用三大关键技术:1) 构建含18.7万种条形码变体的HIV-1病毒库,通过深度测序追踪病毒谱系;2) 开发BI-seq技术同步检测前病毒条形码与整合位点,灵敏度达单分子水平;3) 整合ENCODE数据库的染色质免疫沉淀测序(ChIP-seq)数据,分析15,305个整合位点的表观遗传特征。实验设计涵盖早期感染、ART抑制和治疗中断后反弹三个阶段,共分析20只人类化小鼠的890个病毒RNA条形码和504个前病毒条形码。
【Barcoded HIV-1揭示病毒持久性】研究首先验证了条形码病毒与野生型具有相似的复制能力。通过比较三个感染阶段的病毒多样性发现,尽管血浆病毒RNA在ART期间被有效抑制,但前病毒DNA的遗传多样性始终保持稳定,提示病毒库具有强大的稳定性。
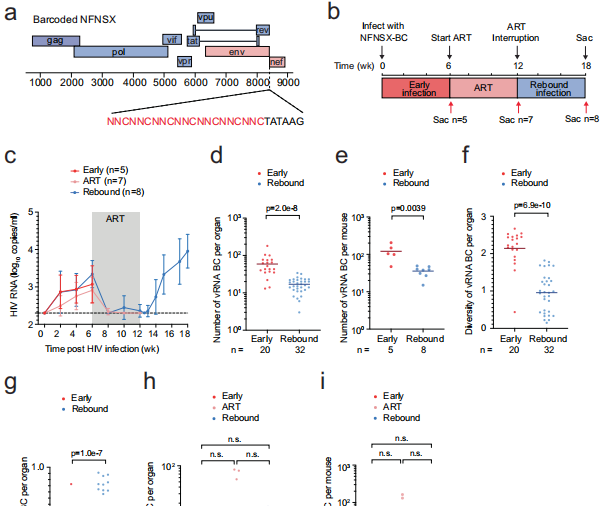
【病毒播种与病毒血症关联】研究发现病毒血症相关前病毒具有更高的"播种分数"(每个条形码对应的整合位点数),尤其在反弹期更为显著。线性回归分析显示,前病毒条形码丰度与播种分数呈正相关,证实活跃复制期病毒播种是前病毒扩增的主要驱动力。
【增殖性细胞克隆的存活机制】通过量化21,296个感染细胞发现,33.2%属于增殖性克隆(UMI per IS>1)。这些克隆在ART期间仍保持稳定规模,且与病毒血症显著相关——携带病毒血症相关前病毒的克隆增殖概率高达非病毒血症相关前病毒的8.8倍。值得注意的是,高度增殖的克隆反而表现出较低的病毒播种能力。
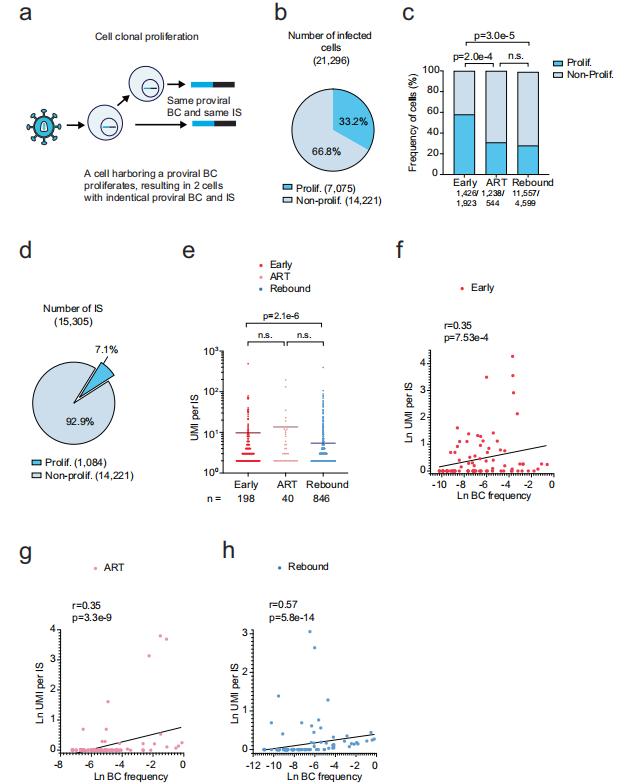
【整合位点的基因组特征】全基因组分析显示,仅3.1%的整合位点位于癌症相关基因,且增殖性克隆中致癌基因富集程度与非增殖克隆无差异。但整合在WWC1(细胞增殖相关基因)同方向的克隆显示出更强的增殖能力,不过这类克隆仅占全部增殖细胞的1.2%。
【表观遗传特征与克隆命运】最关键的发现是,增殖性克隆的前病毒显著富集在具有激活型组蛋白标记(H3K4me3、H3K27ac等)的染色质区域,且更靠近转录起始位点(TSS)。相比之下,非增殖克隆中的病毒血症相关前病毒多位于转录抑制区域,提示转录活跃的前病毒易被清除。但增殖性克隆却能突破这种选择压力,使携带激活标记的前病毒得以持续存在。
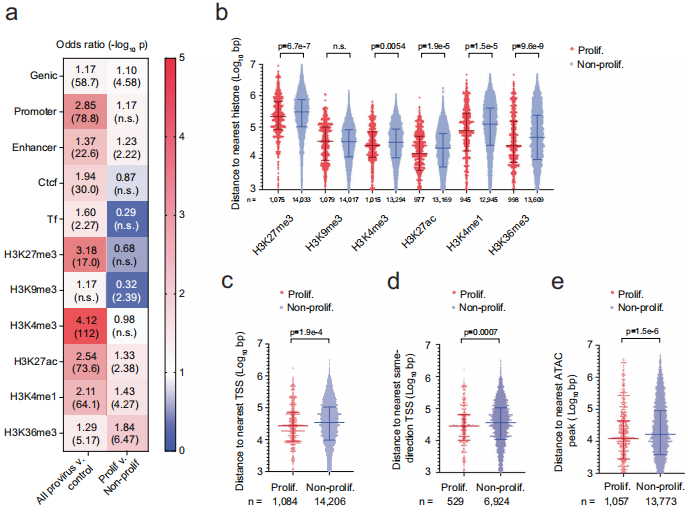
这项研究通过创新性的条形码技术揭示了HIV-1病毒库维持的"双轨制"机制:一方面,大多数转录活跃的前病毒会被选择性清除;另一方面,部分前病毒通过宿主细胞克隆增殖获得持久性,这些克隆具有独特的表观遗传特征使其能逃避免疫清除。该发现不仅解释了为什么长期ART难以根除病毒库,更重要的是指出增殖性克隆是未来靶向干预的关键对象。研究建立的BI-seq技术平台为评估各种治愈策略提供了强大工具,而发现的表观遗传特征则为开发"锁定"病毒库的新型疗法提供了分子靶点。
 生物通微信公众号
生物通微信公众号
知名企业招聘