
-

生物通官微
陪你抓住生命科技
跳动的脉搏
人类糖原脱支酶(hsGDE)的分子结构与催化机制解析及其在糖原贮积症III型(GSD III)中的病理机制研究
【字体: 大 中 小 】 时间:2025年07月02日 来源:Nature Communications 14.7
编辑推荐:
本研究通过冷冻电镜技术解析了人类糖原脱支酶(hsGDE)的3.23 ?高分辨率结构,揭示了其底物选择性和双功能催化机制。研究人员针对21种GSD III相关突变体进行功能分析,发现突变通过破坏催化活性、糖原结合区域或整体结构稳定性导致疾病。该成果为理解hsGDE在糖原代谢中的作用及开发GSD III靶向疗法奠定基础。
糖原是动物细胞中重要的能量储备分子,其精确降解对维持血糖平衡至关重要。糖原脱支酶(GDE)作为糖原降解过程中的关键双功能酶,同时具有4-α-葡聚糖转移酶(GT)和淀粉-α-1,6-葡萄糖苷酶(GC)活性,能协同糖原磷酸化酶完成糖原的完全降解。然而,GDE功能缺陷会导致限糊精异常积累,引发糖原贮积症III型(GSD III)——一种以肝肿大、低血糖和生长迟缓为特征的遗传代谢病。尽管酵母和细菌GDE结构已被解析,但人类GDE(hsGDE)的结构与功能机制仍不清楚,特别是其对复杂糖原底物的选择性识别机制,以及GSD III致病突变的分子基础亟待阐明。
南方科技大学的研究团队通过冷冻电镜(cryo-EM)解析了hsGDE的3.23 ?高分辨率结构,结合分子动力学(MD)模拟和酶活性分析,系统研究了其底物选择性和催化机制。研究还构建了21种GSD III相关突变体,揭示了突变导致疾病的多种分子途径。该成果发表于《Nature Communications》,为理解hsGDE在糖原代谢中的核心作用及开发GSD III精准治疗策略提供了重要依据。
研究主要采用冷冻电镜技术解析hsGDE三维结构,通过分子动力学模拟分析底物结合模式,利用体外酶活性实验测定野生型和突变体的GT/GC活性,并采用糖原结合实验评估突变对底物亲和力的影响。
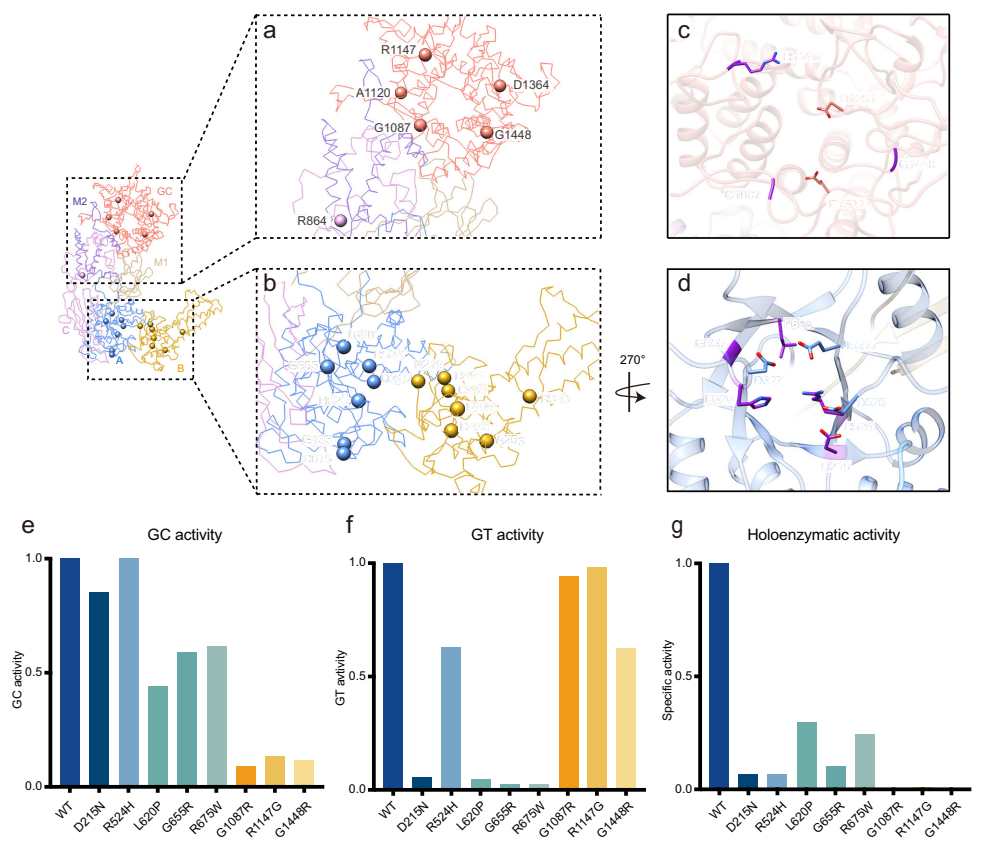
研究成功获得hsGDE的3.23 ?冷冻电镜结构,揭示其由四个结构域组成:GT结构域(含A、B、C亚域)、GC结构域以及两个中间结构域M1和M2。GT与GC结构域分别位于分子两端,通过M1/M2结构域连接,形成独特的空间排布。与白色念珠菌GDE(cgGDE)相比,hsGDE底物结合口袋具有更多正电荷残基,可能增强与带负电糖原的相互作用。

通过MD模拟发现,麦芽五糖(maltopentaose)以垂直方向结合于GT结构域的A/B域间口袋,其非还原端与F557、E579等残基形成特异性相互作用。结合口袋独特的化学环境(一侧极性、一侧疏水)和空间限制(由柔性B域调节)共同决定了底物选择性。实验证实,破坏这些关键相互作用(如F557A突变)会显著降低GT活性但不影响底物结合。
GC结构域采用(α/α)6-桶状折叠,保守催化残基D1261和E1502参与α-1,6-糖苷键水解;GT结构域则具有典型的(β/α)8-桶状结构,催化三联体D526/E555/D627负责糖基转移。突变实验显示,这些催化残基的突变会选择性破坏相应活性而不影响另一功能。
对21种临床突变的系统分析揭示了四种致病途径:
意外发现hsGDE可通过GC结构域形成二聚体,其组装受pH和ATP调控,暗示可能存在新的活性调控机制。
该研究首次在原子水平揭示了hsGDE的工作机制,阐明了GSD III的分子病理基础。特别值得注意的是,不同突变通过多种途径导致疾病,这解释了GSD III的临床异质性。发现hsGDE二聚化现象为理解其活性调控提供了新视角。研究成果不仅填补了糖原代谢领域的关键知识空白,更为开发针对特定突变类型的个性化治疗方案奠定了理论基础。未来可基于这些结构信息设计小分子药物,或通过基因治疗修复致病突变,为GSD III患者带来新的治疗希望。
 生物通微信公众号
生物通微信公众号
知名企业招聘