
-

生物通官微
陪你抓住生命科技
跳动的脉搏
质子与光子辐射中LET对微核诱导的影响机制解析
【字体: 大 中 小 】 时间:2025年07月07日 来源:Scientific Reports 3.8
编辑推荐:
本文针对辐射生物学核心问题,探讨不同线性能量转移(LET)下质子与光子辐射诱导微核(MN)的差异性。研究团队通过七种细胞系的辐射实验,结合细胞阻滞微核(CBMN)检测技术,首次揭示MN形成与剂量呈线性相关(PCMN随剂量显著上升,p<0.001),但未发现LET(0.6 keV/μm vs 6.5 keV/μm)的定量影响。这一突破性发现挑战了传统高LET必然增加MN产出的认知,为质子治疗相对生物学效应(RBE)的临床优化提供了关键实验依据。
辐射损伤的"微观标尺":微核谜题的新启示
在肿瘤放射治疗领域,质子治疗因其独特的布拉格峰(Bragg peak)物理特性,能精准杀伤肿瘤细胞并保护周围健康组织。然而,质子与光子辐射的生物效应差异仍是未解之谜,尤其是线性能量转移(Linear Energy Transfer, LET)——即单位径迹长度上沉积的能量——对DNA损伤标志物微核(Micronuclei, MN)的影响长期存在争议。微核作为辐射暴露的生物剂量计,由染色体断片或整条染色体在细胞分裂期错误包裹形成,其数量与DNA损伤程度密切相关。更关键的是,近年研究发现微核破裂可激活cGAS/STING免疫通路,触发抗肿瘤免疫反应,使其成为放疗联合免疫治疗的潜在桥梁。
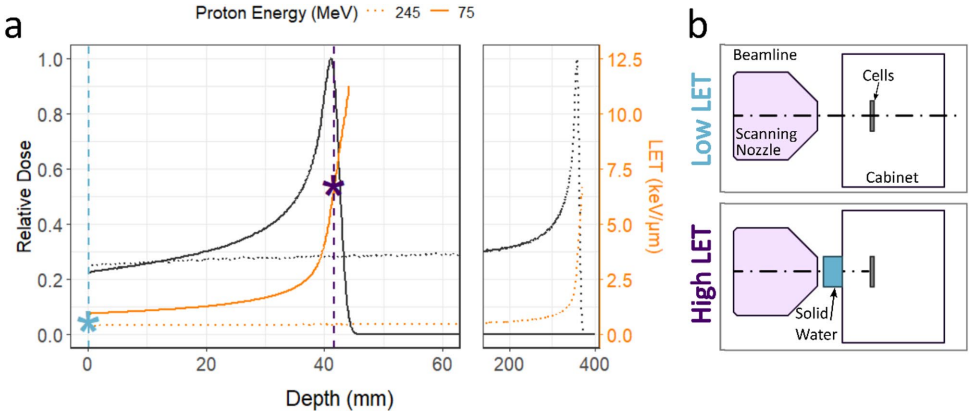
传统理论认为,高LET辐射(如质子布拉格峰末端)因能量沉积更密集,应产生更复杂的DNA双链断裂(DSBs),进而增加微核形成。但既往研究存在两大局限:一是仅用单一细胞系,忽略不同细胞对辐射响应的异质性;二是多聚焦超高LET粒子(如碳离子、α粒子),缺乏对临床质子治疗相关LET范围(0.6–6.5 keV/μm)的系统分析。英国曼彻斯特大学Charlotte J. Heaven团队在《Scientific Reports》发表的研究,首次通过多细胞系模型揭示LET与微核的复杂关系,为质子治疗的生物学优化提供新视角。
关键技术方法
研究采用七类细胞系(含正常视网膜上皮RPE1、肺癌H358、骨肉瘤MG63等),分三组接受:

突破性结果解析
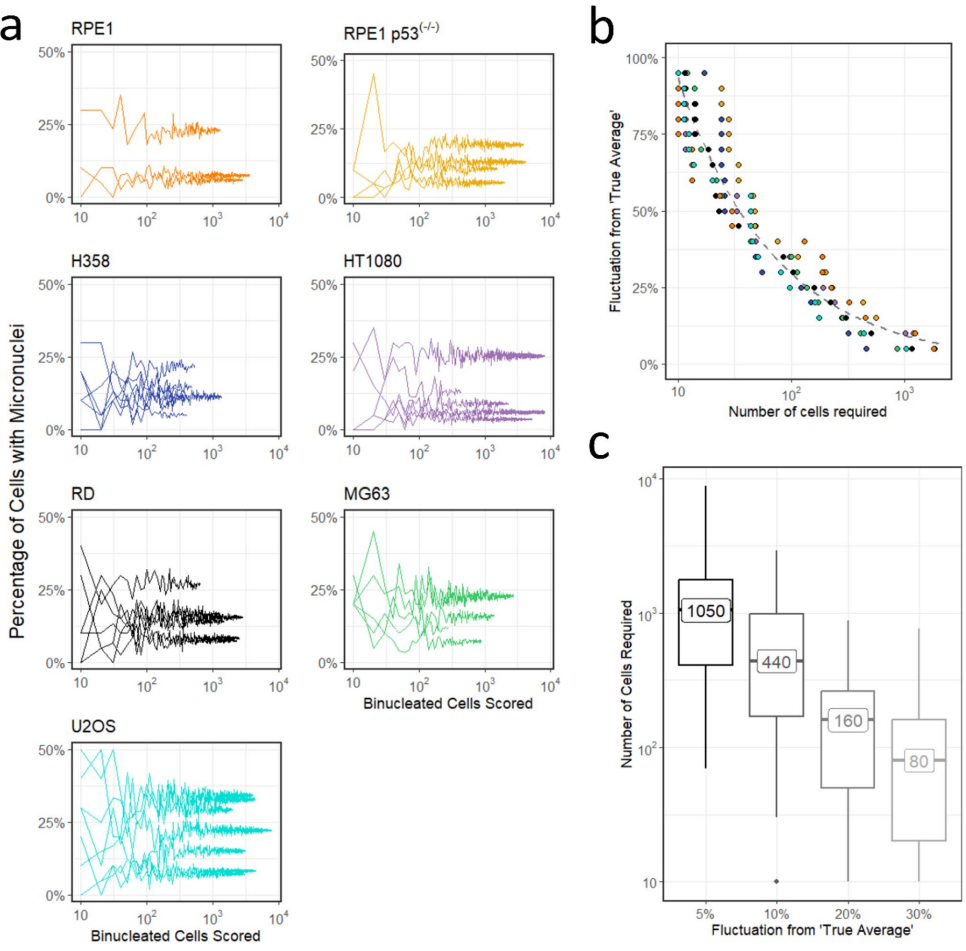
基线微核的"细胞指纹"
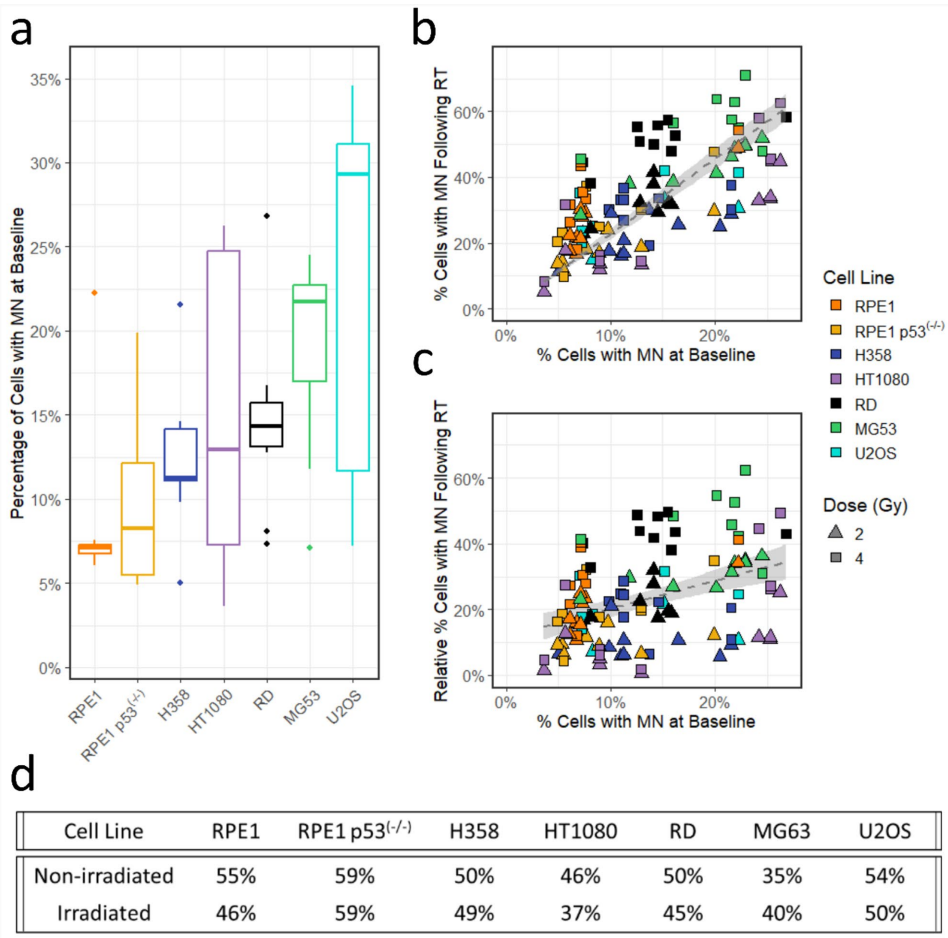
不同细胞系自发微核率差异显著(如U2OS波动最大,RPE1最稳定)。关键发现是:基线PCMN高的细胞,辐照后微核诱导率也更高(p<0.001)。即使扣除基线值,此趋势仍存在(图4),暗示细胞固有遗传不稳定性主导微核易感性。
辐射响应的三重悖论
结论与临床启示
本研究首次在多细胞系模型中证实:微核形成是剂量依赖性而非LET依赖性的生物过程。尽管质子高LET(6.5 keV/μm)理论上应引发更复杂DNA损伤,实际微核产出却与低LET质子(0.6 keV/μm)甚至光子无统计学差异。这一发现挑战了"高LET必然增加染色体碎片化"的假设,揭示DNA损伤与微核间存在未被认知的调控层——例如微核稳定性(破裂速率)或线粒体活性氧(ROS)的调节作用。
对质子治疗的意义尤为深远:目前临床统一采用RBE1.1(相对生物学效应)估算质子生物效应,但本研究说明微核作为DNA损伤标志物无法区分质子与光子的生物效应差异,支持了RBE值应个体化制定的观点。未来需深入探索:
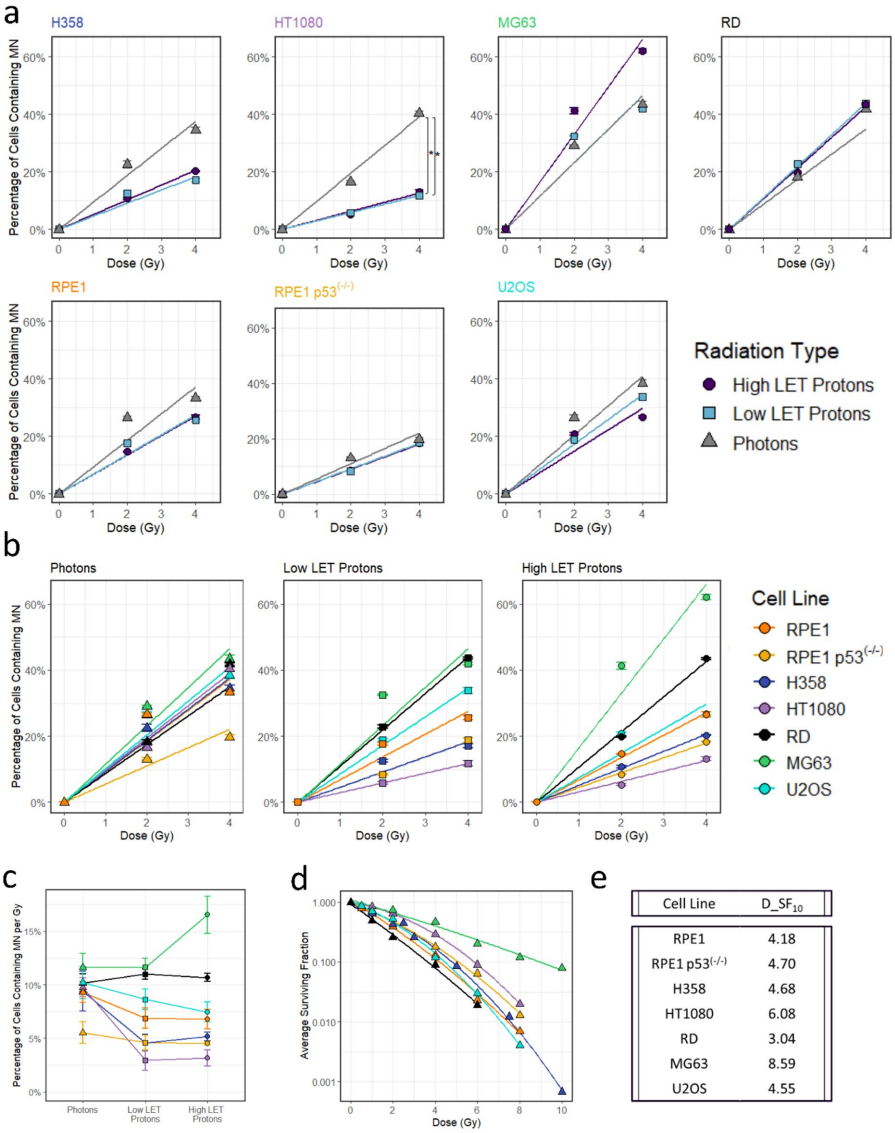
正如作者总结:"剂量、微核与LET的关系比预期更复杂"。这项研究不仅为辐射生物剂量学提供新标准,更启示我们:精准放疗需跨越物理剂量层面,深入解析细胞命运的分子密码。
 生物通微信公众号
生物通微信公众号
知名企业招聘