
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:胶质母细胞瘤的现状与未来治疗前景
【字体: 大 中 小 】 时间:2025年07月10日 来源:Signal Transduction and Targeted Therapy 40.8
编辑推荐:
这篇综述全面探讨了胶质母细胞瘤(GBM)的分子特征、肿瘤微环境(TME)及新兴疗法,重点分析了EGFR/PDGFR/PI3K-AKT-mTOR通路、表观遗传调控(如MGMT甲基化)及免疫治疗(如CAR-T、溶瘤病毒)的突破性进展,为改善患者生存提供了多学科框架。
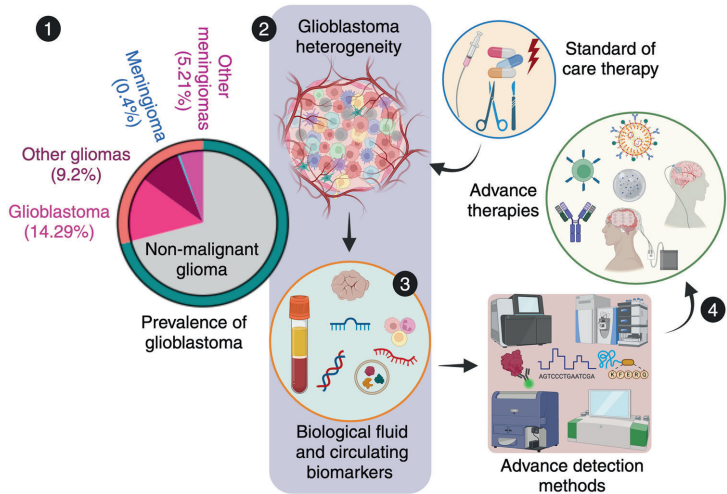
胶质母细胞瘤(GBM)作为最具侵袭性的脑肿瘤,其分子异质性表现为EGFR扩增、IDH突变及TERT启动子突变等驱动事件。DNA甲基化谱(如G-CIMP亚型)和循环生物标志物(ctDNA、外泌体miR-21)革新了诊断体系,其中MGMT启动子甲基化可预测替莫唑胺(TMZ)敏感性。
GBM的免疫逃逸源于肿瘤相关巨噬细胞(TAMs)和髓系来源抑制细胞(MDSCs)构成的免疫抑制生态。PD-1/PD-L1轴和IDO1介导的色氨酸代谢抑制T细胞功能,而CSF-1R抑制剂可重塑M2型巨噬细胞极化。
针对EGFRvIII的单抗(如ABT-414)和PI3K抑制剂(如Buparlisib)虽临床效果有限,但联合代谢干预(如抑制2-HG生成)可克服耐药性。缺氧诱导因子HIF-1α通过激活糖酵解(HK2上调)促进肿瘤存活,靶向脂质代谢(FASN抑制剂)成为新策略。
肿瘤治疗电场(TTF)通过干扰有丝分裂延长生存期,而神经干细胞(NSCs)搭载溶瘤病毒(如CRAd-S-pk7)可跨越血脑屏障(BBB)。纳米颗粒(如金纳米棒)联合光热疗法显著抑制肿瘤生长。
GSC干性维持(SOX2/OCT4)和T细胞耗竭(TOX/PD-1hi)仍是治疗难点,而CAR-T双靶点设计(EGFR/IL13Rα2)和表观遗传药物(DNMT抑制剂)展现出协同潜力。精准医学需整合单细胞测序与AI模型以优化个体化方案。

 生物通微信公众号
生物通微信公众号
知名企业招聘