
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:细胞内液滴究竟如何工作?
【字体: 大 中 小 】 时间:2022年11月15日 来源:nature
编辑推荐:
十多年前,科学家们开始在细胞内发现特殊的液滴。现在,研究人员正试图弄清楚这些无处不在的珠子是如何形成的以及它们有什么作用。
多年来,如果你问一位科学家他们如何想象细胞的内部工作,他们可能会说一个组织严密的工厂,不同的部门在划定的装配线上执行专门的任务。现在问这个问题,他们可能更倾向于把细胞比作一个混乱的开放式办公室,有热办公桌区,不同类型的细胞物质聚集在一起完成一项任务,然后分散到其他区域。
科学家在观察细胞的任何地方,都能看到成群的蛋白质和RNA似乎粘在一起,结合成与周围环境截然不同的珍珠状液滴。这些动态的隔间使细胞能够执行基本的功能,从基因控制和DNA修复到废物处理和应激反应。它们通常是短暂的,不受膜的包围——不像其他细胞成分,如线粒体,是膜结合的。当一滴不再被需要时,它就会消失。
这些短暂的珠子是通过一种叫做相分离的过程产生的,这种过程涉及到由于分子密度或相互作用方式的差异而使分子群彼此隔离。10年前,这一想法在生物学家中开始流行,自2017年以来,相关出版物的数量每年增长约50%。生物学家援引相分离来解释胚胎如何发育、神经元如何交流、免疫系统如何抵御微生物等等。当这个过程出错时,癌症、糖尿病、自闭症谱系障碍和神经退行性变等疾病似乎就会接踵而至。制药行业已经在探索如何以凝析物为目标,将其作为开发新疗法的途径,目前正在研究的策略旨在打破麻烦的聚集物,或以更微妙的方式微调相行为。
但该领域现在正处于十字路口。在最初匆忙记录下细胞每一个角落和缝隙的现象后,科学家们开始提出更详细的问题。他们想知道这些小球在做什么,它们是如何形成的,更重要的是,如何证明这些无膜的细胞器——或被称为“生物分子凝析物”——真的像许多报道所说的那样广泛存在,对细胞至关重要。研究人员也回应了一些批评家对细胞中相分离描述的准确性的质疑,他们认为除了相分离之外的其他力量也可能产生液滴。但许多生物学家并不需要说服他们。
加拿大多伦多儿童医院的细胞生物物理学家Jonathon Ditlev说:“我们观察到凝析液的形成。现在我们需要证明它们为什么重要。”
“形式服从功能”的设计准则假定物体是为特定目的而建造的。尽管这对建筑师来说是可行的,但它却给生物学家带来了一个难题,他们必须对一个实体进行逆向工程,才能推断出它的用途。
凝析物有各种形状和大小,从病毒大小的微小球体到与细菌相当的更复杂的结构。科学家提出,所有这些相分离液滴的主要功能是作为分子坩埚。通过将组分集中在细胞内的一个地方,液滴可以加速生化过程,并将反应物彼此分离,以防止不必要的相互作用。然而,这种推理往好了说是推论,往坏了说是推测。
田纳西州孟菲斯市圣犹大儿童研究医院的结构生物学家Tanja Mittag说:“有很多基本的生物过程都有论文表明相分离起了作用。”但是,她指出:“这还没有得到严格的证明,所以我认为这需要研究出来。”
要做到这一点,科学家们不仅要了解液滴中聚集在一起的分子数量,还要了解它们在液滴中是如何工作的。只有到那时,研究人员才能开始深入了解这些液滴最初形成的原因。
在Mittag看来,最能令人信服地证明凝析物作用的是达拉斯德州大学西南医学中心的生物化学家Mike Rosen的一项实验。去年,他和他以前的研究生William Peeples展示了如何通过相分离来加速一组酶的动力学过程。他们使用了一个可以3D观察液滴的系统。在凝析物之外,酶的反应以缓慢而稳定的速度进行;而在里面,活动的速度大约是36倍。
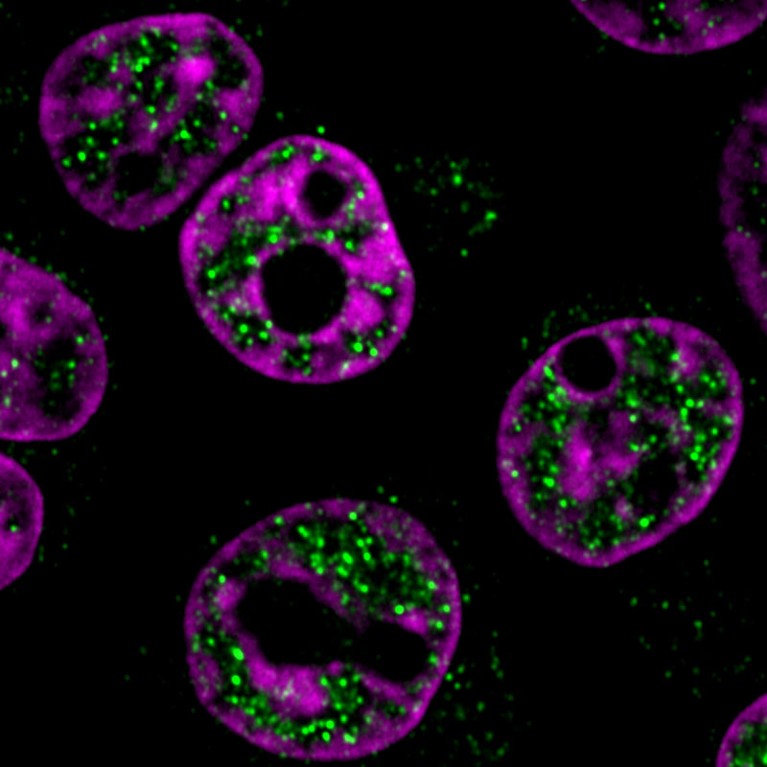
癌症相关蛋白(绿色)聚集在多发性骨髓瘤细胞的细胞核中。来源:Jonathan Henninger
正如其他研究小组所表明的那样,这些酶和它们的伙伴分子的局部浓度的增加部分解释了这些数据。但研究人员还发现,冷凝物给了这个过程额外的结构:它们帮助酶在空间上组织,提供了一个分子“支架”,这样它们就可以更容易地与反应物合作。少量的反应物进一步加速酶的作用,使整体催化效率更高。9月发表的一项独立研究表明,在大量的酶上也有同样的脚手架效应。
“你会得到这种提高效率和提高专注度的综合效果,”Peeples说,他现在就职于一家隶属于总部位于马萨诸塞州剑桥市的生命科学创新公司Flagship pioneer的早期生物技术公司。或者,换句话说,Peeples说:“你得到了一个双份。”
另一种更好地理解事物如何工作的方法是从零开始构建它。2020年,三个独立的研究团队利用一种被称为应力颗粒3 - 5的专门类型的凝析物完成了这一工作。
这些储存气泡包含蛋白质和RNA,是在细胞或环境困难时形成的,有助于隔离和保护关键的细胞工具,直到条件改善。但是,就像凌乱的衣橱会产生大量危险的灰尘,或在家里成为火灾隐患一样,如果不及时清理,压力颗粒也会对细胞造成伤害。
科学家们之前研究过相分离液滴是如何工作的,方法是制造简单的相分离液滴,并使用药物抑制剂和基因工具调整细胞中的天然凝析物,以检查如果它们受到干扰会发生什么。但这三个小组是第一个从下往上忠实地将冷凝复制品缝合在一起的。通过结合实验技术、理论和详细的原子模拟,他们破译了许多控制凝结水形成的生物物理规则。
例如,他们展示了一种特殊的支架蛋白似乎是应力颗粒组装的中心。当细胞遭遇逆境时,这种名为G3BP1的蛋白质会改变形状,促使附近的RNA分子与它结合,促进聚集。在这一关键的机制洞察的支持下,研究人员现在开始探索这些隔间是如何动态形成和分裂的,以及哪些分子驱动它们生命周期的每个部分。
“这就是体外重建的力量,”参与其中一项研究的中国杭州西湖大学细胞生物学家Peiguo Yang说。
另一个团队在未发表的工作中探索了与疾病相关的蛋白质如何影响冷凝物。凝析物通常有一种黏糊糊的稠度。但是,在这些蛋白质的存在下,结构变得更加僵硬,导致细胞中蛋白质团块的类型,这是许多神经退行性疾病的基础。德国德累斯顿技术大学的生物化学家Simon Alberti说:“我们实际上可以看到在我们构建的颗粒内部发生聚集。”他构建了这些颗粒。
这些努力对于解决冷凝物领域最大的争议之一——冷凝物究竟是如何形成的——应该大有帮助。
北卡罗来纳大学教堂山分校的细胞生物学家Amy Gladfelter指出,大部分证明这些斑点是由相分离产生的证据来自试管实验,这些实验可能不能反映活细胞中的条件——特别是因为这些凝析物比自然的凝析物大了好几个数数。她在一次在线会议上说:“我们一直被吸引去研究这些巨大的、非常甜美的液滴,它们宏观而有魅力。”该会议由德国研究基金会(DFG)和位于密苏里州圣路易斯的华盛顿大学新成立的生物分子凝聚中心于10月下旬召开,旨在讨论凝聚生物学中的开放问题和挑战。
但许多重要的功能可能在科学家看不到的范围内发生。研究人员对分子集中到无膜腔室的精确机制也存在分歧,这些过程即使用最好的技术也很难观察到。因此,尽管生物学家在过去的十年里在试管实验、细胞和动物模型中到处看到凝聚态,但一些批评者担心,这些观察结果可能是海市蜃楼。
要弄清一个斑点是否是相分离的产物,部分挑战在于它们的外观和组成成分存在很大差异。德累斯顿的马克斯·普朗克分子细胞生物学和遗传学研究所的细胞生物学家Tony Hyman和现在新泽西州普林斯顿大学的生物物理学家Cliff Brangwynne在2009年发表的具有里程碑意义的论文中描述了RNA和蛋白质的体块聚集在一起,然后分裂,就像玻璃上的水珠一样。这是第一篇识别流体状相分离斑点的论文。
作者写道:“它们看起来类似于润湿表面的液滴。”(Hyman和Brangwynne因此获得了享有盛誉的2023年生命科学突破奖。)
研究人员将这种现象归因于“液-液相分离”(LLPS),这是一种类似于悬浮在醋中的油滴变粗的分解过程。LLPS似乎在细胞中无处不在——在细胞核中的小体中,在基因活动的位点上,在参与细胞分裂的结构中(见“一群凝析物”)。
但其中一些斑点表现得更像固体而不是液体,或者它们呈现出粘稠的凝胶状稠度。Hyman和Rosen意识到,除了液体的分离外,还有更复杂的生物物理学在起作用,于是在2017年,他们为这些隔间创造了一个包罗万象的名字:生物分子凝聚体。这个名字没有解释这些蛋白质和核酸的组合是如何形成或消失的。Rosen解释道:“这是有意设计成没有机械装置的。
除了油和醋的分解过程,这些网络结构的特定部分之间的物理和化学相互作用也很重要。例如,冷凝物组装的一个热点是缺乏稳定3D结构的蛋白质的摆动位,它们与其他分子和溶剂相互作用,引导相分离。进一步的实验和理论表明,大量的力共同作用产生了凝聚态。
社区中的一些人试图将精确度注入该领域,并指导研究人员找出斑点是通过相分离还是其他方式形成的。
Mittag和计算生物物理学家、华盛顿大学凝析物中心主任Rohit Pappu建立了一个框架,规定了如何检查凝析物是否真的存在,包括凝析物内外密度的差异,以及凝析物内部分子之间的物理交联。他们还提出了测试相分离的方法——比如设计实验来显示浓度阈值以上的液滴形成,因为密度的转变或物理相互作用,或两者都有。
根据Mittag的说法,这个更加正式的过程定义是“在我们对相分离的概念理解方面向前迈出的非常重要的一步”。但是,她承认,这也在某种程度上提高了科学标准,从而产生了更多的问题。“所以,最后,”Mittag说,“我实际上认为我们还没有真正摆脱争议。”
大部分反对意见来自加州大学伯克利分校的生物化学家Robert Tjian。2019年,他和他的同事发表了一篇被广泛阅读的评论,对该领域的科学严谨性提出了质疑——《Science》杂志上的一篇新闻文章使这种批评更加引起共鸣。
Tjian说,他赞赏Mittag和Pappu等科学家为解决他的担忧所做的努力。他对这种超越简单解释的做法表示欢迎。“这显然仍然是一个相当复杂和定义不清的领域,”Tjian说,他期待相分离的支持者进行“实际的识别实验”。该领域的许多人承认,他的谨慎促使他们在科学研究中更加严格。
然而,少数研究人员仍然坚持他们的怀疑态度。今年早些时候,德国多特蒙德马克斯·普朗克分子生理学研究所的机械细胞生物学家Andrea Musacchio发表了一篇对该领域的严厉评价。Pappu和Mittag提出的框架“基本上抹杀了迄今为止关于相分离的全部文献”,他说。许多凝聚态研究人员表示,他的批评是基于有缺陷的论点和对文献的不完整阅读。
很少有人持穆萨奇奥的严厉观点。德克萨斯州休斯顿贝勒医学院的生物物理学家Josh Riback指出,随着时间的推移,科学理解的成熟是很自然的。当谈到这样一个新概念时,他说,“你要从简单开始,然后增加复杂性”。
尽管学术界存在争论,但药物搜寻者正在接受这个概念。自2019年以来,专注冷凝物的生物技术公司,如马萨诸塞州波士顿的露点疗法公司,共筹集了超过5亿美元,老牌公司与冷凝物初创公司签署了合作协议。
大多数对相分离感兴趣的公司都在优先开发用于癌症和神经系统疾病的药物,这两类疾病经常与出错的冷凝有关。有时,这些冷凝物含有有毒的蛋白质,最简单的治疗方法是用药物溶解它们或从一开始就阻止它们的形成。
例如,在运动神经元疾病(肌萎缩性侧索硬化症)中,许多疾病突变可使冷凝液比平常更粘稠,导致密集聚集,这是退行性神经肌肉疾病的标志。在癌症中,促进或抑制肿瘤的蛋白质可能最终出现在错误的隔层或水平上,导致肿瘤生长。
总部位于中国上海的Etern Therapeutics有一种癌症候选药物正在进行早期临床试验。这种名为ETS-001的实验药物针对的是一种与肿瘤相关的酶。公司联合创始人兼首席执行官和他的同事们已经证明,这种酶的突变形式在凝析液中积累,导致信号级联,从而刺激细胞失控生长。ETS-001与酶结合,阻止凝结物的形成并抑制肿瘤。上个月,朱和他的合作者描述了另一种治疗前列腺癌的候选药物,这种药物可以破坏凝析物,而凝析物被认为是使前列腺癌对某些标准疗法产生抗药性的原因。
其他疾病可能需要更小心地处理凝结物。总部位于纽约的全球最大制药商辉瑞(Pfizer)正与露点公司合作,开发针对肌强直性营养不良症(一种影响肌肉和其他身体系统的罕见遗传疾病)的凝结液靶向治疗方法。在这种疾病中,凝析物往往会积聚在受感染细胞的错误位置,需要稳定而不是摧毁。
露点研究的重点是其他也需要这种细微差别的疾病。公司的生物化学家Phi Luong和他的团队一直在研究一种未披露的神经退行性疾病,并发现受影响细胞的核仁(细胞核中制造蛋白质的核糖体聚集在一起的致密球形凝结物)在患病细胞中呈现出异常的形状。完全打碎核仁会杀死细胞。因此,我们的目标是找到具有更微妙、更强恢复能力的候选药物——“而不是那些只是一种大锤,”Luong说。
由于许多药物倾向于聚集在凝析物中,斑点本身可能代表一种新的给药策略,使药物能够集中在所需的作用部位。
实际上,凝聚物在靶向分子和整个细胞之间提供了一个中间地带。英国剑桥大学的生物物理学家Tuomas Knowles说,它们是理解细胞的一种方式,“你无法通过观察单个的构建模块来真正理解”,他是总部位于马萨诸塞州剑桥的过渡生物公司的联合创始人和首席技术官。
据统计,如果不是数千种,也有数百种疾病状态可能是由凝结水相关机制引发的。“你不能在观察任何器官系统或任何相关疾病时,不考虑致病性突变导致凝析液失调的可能性,”马萨诸塞州剑桥市怀特黑德研究所的生物学家里Rick Young说。他是露点实验室的联合创始人,与他的合著者一起在7月发表了这份分析报告。
Young说:“目前已经研究过的细胞过程都与冷凝有关。这几乎涉及到所有的事情。”