
-

生物通官微
陪你抓住生命科技
跳动的脉搏
吃得太晚会增加患糖尿病的风险!
【字体: 大 中 小 】 时间:2022年03月14日 来源:精准医学趋势
迄今为止最大的随机交叉试验表明,吃得太晚会影响葡萄糖耐量,降低胰岛素水平,这可能与褪黑激素水平升高有关
俗话说,人以食为天。每餐吃什么和怎样吃才能健康是我们每天面临的问题。
为了回答这个问题,科学家们进行了大量的探索。在饮食节律方面,几项小型人群研究和动物研究表明,晚餐吃得太晚会损害健康,增加糖尿病和心血管疾病的风险等[1,2]。
然而,仍然缺乏大规模的基于人口的研究证据来支持这一结论。
最近,来自哈佛大学的Frank AJL Scheer和Richa Saxena教授的团队在西班牙自然晚食人群中进行了一项随机交叉试验。
研究表明,晚吃晚餐时体内褪黑激素水平是早吃晚餐时的3.5倍。餐后血糖升高,胰岛素水平降低。同时,这种负面影响在褪黑素受体基因MTNR1B G等位基因携带者群体中更为明显。
该研究结果发表在美国糖尿病协会的权威杂志《糖尿病护理》上。这项研究是迄今为止关于晚餐时间和糖尿病风险的最大的基于人群的随机交叉研究。
这项研究是在西班牙进行的,研究对象是845名年龄在18-70岁之间、没有糖尿病史和相关药物史的欧洲人。
在交叉试验中,每个受试者进行了两次夜间2小时口服葡萄糖耐量测试(OGTTs),一次是在习惯性睡眠时间前4小时(早晚餐测试,EE),一次是在习惯性睡眠时间前1小时(晚晚餐试验,LE)。
EE试验在≥450 lux的较亮光照条件下进行,LE试验在0 ~ 25 lux的昏暗光照条件下进行,两次试验间隔一周为洗脱期,顺序随机。
与EE试验相比,LE试验血清褪黑素水平高3.5倍。
OGTTs实验结果显示,LE试验中餐后血糖明显升高,曲线下面积(AUC)较EE试验增加8.3%。
这表明晚吃晚餐确实会损害葡萄糖耐量和减少胰岛素分泌。
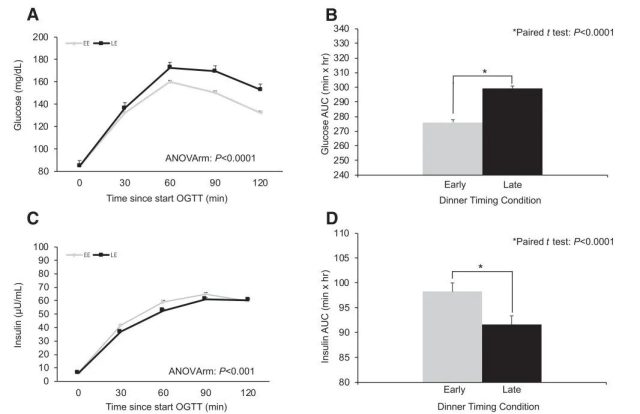
不同晚餐时间餐后血糖和胰岛素水平的结果
褪黑激素是大脑松果体分泌的一种激素,白天受到抑制,晚上活跃。
褪黑激素可能因其改善睡眠质量和调整昼夜节律的能力而闻名。
同时,褪黑素可作用于多种内分泌器官,调节相应的激素分泌[4]。
褪黑激素的作用复杂多样,研究表明,内源性褪黑激素水平的增加可能导致糖耐量受损[5]。
由于夜间内源性褪黑激素水平升高,晚餐吃得太晚可能会影响葡萄糖耐量,这可能与褪黑激素有关。
褪黑素受体1B基因(Melatonin receptor 1B gene, MTNR1B)是一种与2型糖尿病相关的基因,不仅调节昼夜节律,而且在葡萄糖代谢中也起着重要作用,被认为是昼夜节律调节与葡萄糖代谢之间的桥梁。
MTNR1B基因有三种基因型(CC、CG、GG),其中G等位基因表达越多,胰岛[7]褪黑素受体表达越高。
为了进一步探索褪黑激素、用餐时间和葡萄糖代谢之间的关系,研究人员检查了所有受试者的MTNR1B基因型。
研究发现,在MTNR1B基因的三种基因型中,G等位基因越多的受试者葡萄糖代谢越差。
这表明褪黑素受体的高表达损害胰岛功能,增加餐后血糖。

不同MTNR1B基因型受试者的餐后血糖和餐后胰岛素水平
研究结果表明,晚餐时间过晚会导致胰岛素分泌缺陷,从而导致餐后血糖升高。
这种胰岛素分泌的缺陷可能是由于褪黑激素水平升高。同时,MTNR1B基因的G等位基因是2型糖尿病的风险等位基因,G等位基因较多的患者更容易因进食太晚而损害胰岛功能。
这项研究的结果对于预防2型糖尿病很重要,特别是对于那些睡前进食的人,包括夜班工人、有时差反应和饮食失调的人,以及大量服用褪黑素补充剂的人。
这些人在吃饭时应该意识到潜在的糖尿病风险,对于一般人群来说,最好在睡前几个小时内避免进食。
引用:
1. Mattson MP, Allison DB, Fontana L, Harvie M, Longo VD, Malaisse WJ, Mosley M, Notterpek L, Ravussin E, Scheer FA, Seyfried TN, Varady KA, Panda S. Meal frequency and timing in health and disease. Proc Natl Acad Sci U S A. 2014 Nov 25;111(47):16647-53. doi: 10.1073/pnas.1413965111. Epub 2014 Nov 17. PMID: 25404320; PMCID: PMC4250148.
2. Mason IC, Qian J, Adler GK, Scheer FAJL. Impact of circadian disruption on glucose metabolism: implications for type 2 diabetes. Diabetologia. 2020 Mar;63(3):462-472. doi: 10.1007/s00125-019-05059-6. Epub 2020 Jan 8. PMID: 31915891; PMCID: PMC7002226.
3. Xie Z, Chen F, Li WA, Geng X, Li C, Meng X, Feng Y, Liu W, Yu F. A review of sleep disorders and melatonin. Neurol Res. 2017 Jun;39(6):559-565. doi: 10.1080/01616412.2017.1315864. Epub 2017 May 1. PMID: 28460563.
4. Luboshitzky R, Lavie P. Melatonin and sex hormone interrelationships–a review. J Pediatr Endocrinol Metab. 1999 May-Jun;12(3):355-62. doi: 10.1515/jpem.1999.12.3.355. PMID: 10821215.
5. Bandín C, Scheer FA, Luque AJ, ávila-Gandía V, Zamora S, Madrid JA, Gómez-Abellán P, Garaulet M. Meal timing affects glucose tolerance, substrate oxidation and circadian-related variables: A randomized, crossover trial. Int J Obes (Lond). 2015 May;39(5):828-33. doi: 10.1038/ijo.2014.182. Epub 2014 Oct 14. PMID: 25311083.
6. Garaulet M, Lopez-Minguez J, Dashti HS, Vetter C, Hernández-Martínez AM, Pérez-Ayala M, Baraza JC, Wang W, Florez JC, Scheer FAJL, Saxena R. Interplay of Dinner Timing and MTNR1B Type 2 Diabetes Risk Variant on Glucose Tolerance and Insulin Secretion: A Randomized Crossover Trial. Diabetes Care. 2022 Jan 10:dc211314. doi: 10.2337/dc21-1314. Epub ahead of print. PMID: 35015083.
7. Morris CJ, Yang JN, Garcia JI, Myers S, Bozzi I, Wang W, Buxton OM, Shea SA, Scheer FA. Endogenous circadian system and circadian misalignment impact glucose tolerance via separate mechanisms in humans. Proc Natl Acad Sci U S A. 2015 Apr 28;112(17):E2225-34. doi: 10.1073/pnas.1418955112. Epub 2015 Apr 13. PMID: 25870289; PMCID: PMC4418873.