
-

生物通官微
陪你抓住生命科技
跳动的脉搏
《Nature综述》CRISPR在癌症研究、诊断和治疗中的应用
【字体: 大 中 小 】 时间:2022年04月02日 来源:精准医疗
编辑推荐:
《Nature Reviews Cancer》杂志发表了一篇题为《CRISPR in cancer biology and therapy》的综述文章,系统地综述了CRISPR系统在癌症研究、诊断和治疗方面的最新进展。
自问世以来,CRISPR基因编辑系统已成为研究细胞功能的强大工具。它对我们理解癌症生物学有重大影响,并继续推动新的发现,加速癌症诊断和治疗的发展。
最近,《Nature Reviews Cancer》杂志发表了一篇题为《CRISPR in cancer biology and therapy》的综述文章,系统地综述了CRISPR系统在癌症研究、诊断和治疗方面的最新进展。
癌症精准医疗策略依赖于发现促进癌症生长的基因突变,而CRISPR基因编辑技术可以快速有效地产生基因敲除,调节内源性基因表达和复制与癌症相关的基因组变化。
由于CRISPR技术的简单和高效,产生基因敲除小鼠模型已成为常规。此外,通过选择性地将CRISPR基因编辑系统的所有组成部分引入特定的体细胞,可以生成组织特异性癌症模型。
例如,使用CRISPR编辑造血干细胞中的Tet2、Runx1、Dnmt3a、Nf1和Smc3基因可以刺激急性髓系白血病。
将CRISPR传递到肝脏、胰腺或肺部,可以快速生成具有复杂表型的癌症模型。
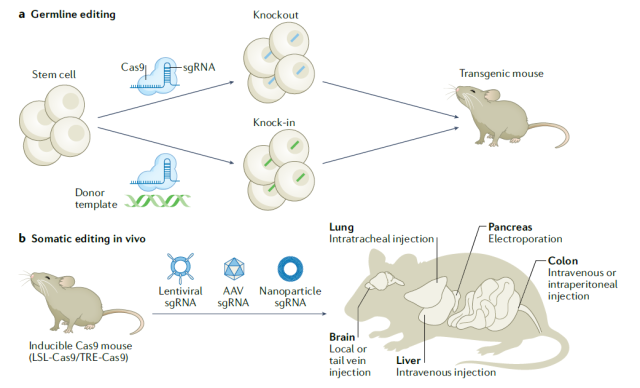
利用CRISPR技术生成不同类型的癌症模型
这篇综述的作者指出,CRISPR技术对癌症研究的最大影响可能是CRISPR筛查。
该筛选利用针对基因组中不同基因的引导RNA (guide RNAs, gRNAs)库,系统地敲除细胞系或类器官中的任何基因,然后观察敲除后对癌细胞生长或药物反应的影响。
CRISPR在癌症研究中的另一个重要应用是追踪癌细胞的谱系变化。
癌症的一个标志是它的异质性,癌细胞积累遗传变异,导致产生具有明显特征的细胞克隆。
理解肿瘤内部的异质性,跟踪新克隆体的生成和进化,让科学家对肿瘤的发生有了更全面的了解。
目前,研究人员已经开发了多种基于CRISPR的跟踪策略,可以在包含多个细胞克隆的混合细胞群中发现不同的细胞克隆,并跟踪它们随时间的动态变化。
CRISPR技术可以将独特的条形码引入细胞,用来标记癌细胞谱系。
最新的CRISPR记录系统能够在特定时间在基因组中引入标记,通过分析这些不同的标记,可以构建不同癌细胞克隆之间的谱系关系。
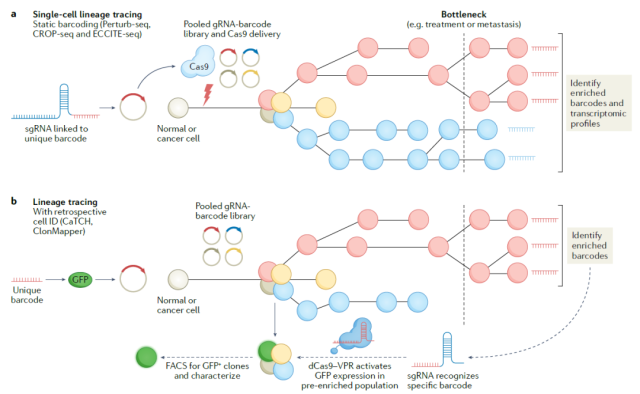
追踪癌细胞克隆系的不同CRISPR策略
癌症的早期检测为治愈癌症提供了最好的机会,而CRISPR技术可以帮助开发更敏感的分子诊断工具,以帮助癌症的早期检测。基于Cas12和Cas13的CRISPR分子诊断系统已被用于从患者肿瘤组织活检中识别癌症相关的基因突变。
它们在发现特定的致癌基因突变序列后,通过裂解携带荧光报告蛋白的RNA序列发出荧光信号。
在COVID-19病毒大流行期间,这项技术被用于生产新型冠状病毒的快速和敏感检测。
同样的平台可以用来生成高度敏感的个性化癌症发现和监测系统。
此外,CRISPR系统还可以用于精确切割基因组特定区域的DNA片段。
与传统的随机基因组片段相比,该方法可以丰富感兴趣的DNA片段,可以与下一代基因测序相结合。在美国,特定基因的基因突变可以在非常小的样本容量中发现。这项技术目前正在临床试验中评估,用于检测卵巢癌p53突变。
在癌症治疗中,CRISPR技术的主要应用之一是改造免疫细胞以产生抗癌免疫疗法。
多个研究团队已经证明,使用CRISPR基因编辑靶向T细胞中的PD-1表达可以增加T细胞的抗癌活性。这些候选疗法已经进入临床试验阶段。
此外,CRISPR基因编辑可以用来摧毁人类白细胞抗原(HLA)内源性T细胞表面的受体,利用健康的捐赠者生产同种异体T细胞的“通用”CAR-T细胞疗法,从而减少免疫排斥反应和移植物抗宿主病的风险,这些都是由同种异体细胞输注引起的。
此外,利用CRISPR/Cas9技术,CAR表达序列还可以特异性地插入到细胞的T细胞受体α恒定区(TRAC)的基因位点,从而使CAR的表达一致。
在体外和小鼠模型中,通过这种方法产生的CAR-T细胞比传统的CAR-T细胞表现出更高的抗癌活性。
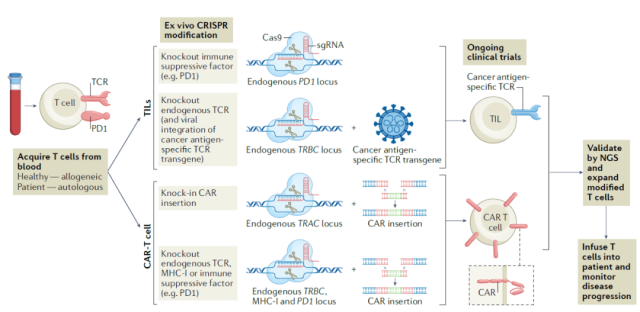
CRISPR可以改造T细胞的多种方式
除了体外工程T细胞疗法外,使用CRISPR基因编辑直接针对导致癌症的遗传变异,是一个有吸引力但也非常困难的挑战。
理论上,CRISPR基因编辑可以直接纠正导致癌症的基因突变,或者杀死产生特定基因突变的癌细胞,从而抑制肿瘤生长。
然而,这一策略需要克服多个障碍,包括肿瘤特异性疗法的交付,以及对高效基因编辑的需求。
目前的临床前研究已经确定了几种肿瘤特异性基因编辑策略。例如,靶向致癌基因融合的CRISPR基因编辑系统可以选择性地靶向肿瘤细胞,同时破坏促进肿瘤生长的基因突变。
另一项临床前研究将CRISPR-Cas13a系统的转录置于NF-κB转录因子的控制之下。
由于NF-κB在多种癌症中过度激活,该策略可在癌细胞中特异性表达CRISPR-Cas13a系统,敲除癌基因的表达,达到抑制癌细胞生长的效果。
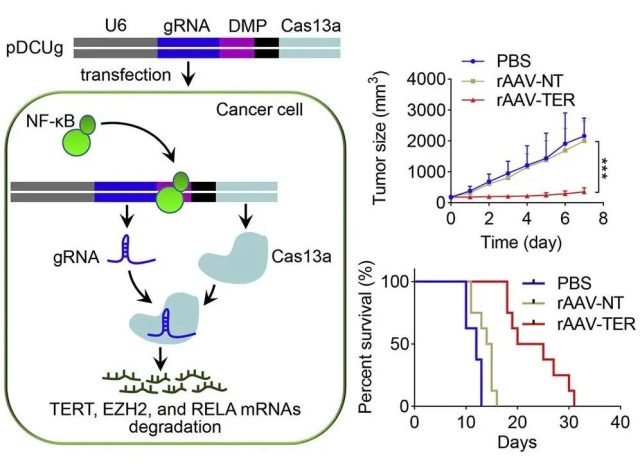
利用NF-κB控制CRISPR-Cas13a系统的表达,对癌基因进行肿瘤特异性降解
在传递技术方面,脂质纳米颗粒(LNP)在传递2019-nCoV mRNA方面取得了巨大的成功。
的使用现况提供Cas9-encoding mRNA和gRNA有效目标PLK1,基因必不可少的有丝分裂,在概念验证研究中,体内基因编辑效率达到70%胶质母细胞瘤的小鼠模型,导致细胞凋亡和抑制肿瘤的生长和50%的存活率提高了30%。
靶向结合在LNPs表面的肿瘤特异性抗原的抗体也成功地驱动分散的肿瘤选择性吸收LNPs,提高了肿瘤特异性编辑效率。
总体而言,这些临床前研究显示了体内CRISPR基因编辑在癌症治疗中的潜力,尽管将体内CRISPR基因编辑转化为可行的临床阶段抗癌疗法仍需要大量努力。
尽管CRISPR在癌症生物学中有广泛的应用,但这篇综述的作者指出,这项技术的进一步发展,特别是在临床治疗方面,仍然需要克服几个局限性。Cas酶引起的DNA双链断裂可触发DNA片段的意外丢失,在某些情况下,驱动染色体断裂(chromothripsis),从而影响正常的细胞功能。
CRISPR技术引起的DNA双链断裂损伤可能刺激p53信号通路,导致细胞死亡或p53功能降低的细胞选择。此外,CRISPR系统的脱靶编辑潜力一直是研究人员关注的问题。
然而,尽管这些潜在的限制是推动CRISPR技术进一步发展的重要限制,科学家们现在已经开发出了检测和减少这些事件发生的工具。作者表示,他们可能不会显著阻碍CRISPR技术的临床应用。
在未来的5-10年里,CRISPR技术将真正进入临床治疗阶段,CAR-T治疗和其他免疫细胞工程的工作预示着它们在癌症治疗中的作用。
在科学研究中,CRISPR技术已经开始解决许多癌症的基本问题。通过描述单个基因在癌细胞行为中的作用,它将为构建下一代免疫疗法提供基础,揭示非编码区和调控元件在肿瘤发生和许多其他领域的作用。CRISPR技术已经并且将会成为我们理解和治疗人类癌症的关键工具之一。
参考:https://www.nature.com/articles/s41568-022-00441-w