
-

生物通官微
陪你抓住生命科技
跳动的脉搏
当单细胞遇上空间技术:研究人员绘制人类妊娠早期的关键细胞过程
【字体: 大 中 小 】 时间:2023年12月28日 来源:10x Genomics
编辑推荐:
在这篇文章中,我们将描绘人类发育最早期阶段的细胞和分子事件,包括子宫内的成功着床和胎盘的形成。
当两种技术强强联合来解决复杂生物学中的“what”和“where”问题时,会发生什么?我们在“当单细胞遇上空间技术”系列文章中分享了这些故事,并重点介绍了充分利用两种技术优势的研究,体现了它们联用后如何发挥更大的作用。
在这篇文章中,我们将描绘人类发育最早期阶段的细胞和分子事件,包括子宫内的成功着床和胎盘的形成。
妈妈和宝宝在妊娠早期亲密接触
从关系和生物学的角度来看,母亲和婴儿之间的密切关系有着深远的意义。胎盘的发育需要母亲和胎儿的合作——双方提供细胞来形成临时器官,对发育中的胎儿进行保护和滋养(1)。
具体来说,胚胎上皮外层的滋养层细胞在母体子宫着床后开始了一项重大的建设项目(2)。绒毛外滋养层(EVT)细胞浸润到妊娠子宫的粘膜层(又称为蜕膜),并向母体动脉网络趋近,随后将其转化为“高传导性血管”,在妊娠期间通过胎盘向胎儿提供氧气和营养物质(2)。
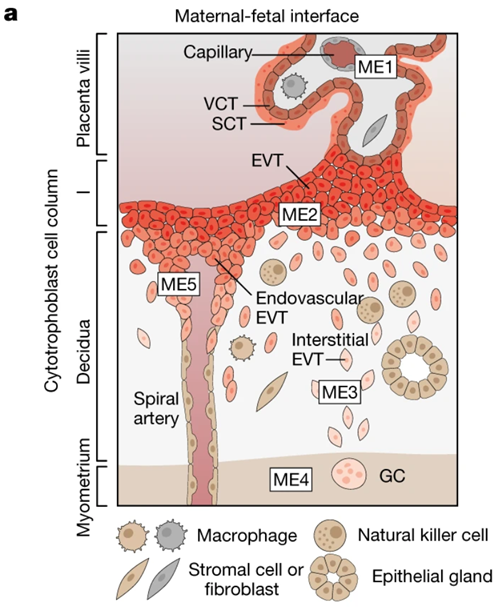
Arutyunyan等人论文中的图1a。母胎界面的示意图。图中显示了绒毛外滋养层(EVT)细胞正在浸润母体蜕膜和螺旋动脉。图片来源:Arutyunyan A, et al. Spatial multiomics map of trophoblast development in early pregnancy. Nature 616: 143–151 (2023). doi: 10.1038/s41586-023-05869-0. (CC BY 4.0)
重塑母体组织以及在母亲和胎儿的亲密交汇点建立胎盘的这些步骤也与一些常见的妊娠疾病有关,有时这些疾病会致命。其中包括子痫前期——这种疾病导致母亲血压异常等症状,很可能是由胎盘形成过程中母体动脉重塑不当引起的(3,4)。
深入表征胎盘形成过程中母胎界面上的细胞关系,不仅对了解妊娠疾病背后的机制至关重要,同时也有助于确定干预措施,以确保更健康、更安全的妊娠。
单细胞和空间图谱绘制出母胎界面上的两个世界如何碰撞
Wellcome Sanger研究所和剑桥大学的Anna Arutyunyan、Kenny Roberts、Kevin Troulé、Frederick Wong、Megan Sheridan博士及通讯作者Roser Vento-Tormo博士共同领导的研究团队最近对母胎界面进行了研究(2)。为了更好地了解胎盘形成过程中胎儿滋养层细胞与母体蜕膜细胞之间的相互作用,研究团队利用高分辨率单细胞多组学和空间转录组学技术,研究了妊娠早期子宫切除术中的着床部位(2)。
他们的分析结合之前的单细胞数据和新采集的胎盘-蜕膜组织样本,这些样本来自受孕后(PCW)5-13周的18名供体,包括三个2006年以前采集的长期保存组织块。尽管这些存档样本已经冷冻了十多年,但由于长期保存方法得当,且Chromium单细胞基因表达和单细胞多组学ATAC + 基因表达分析灵敏度高,研究人员能够分离出高质量的单细胞和单细胞核数据(2)。
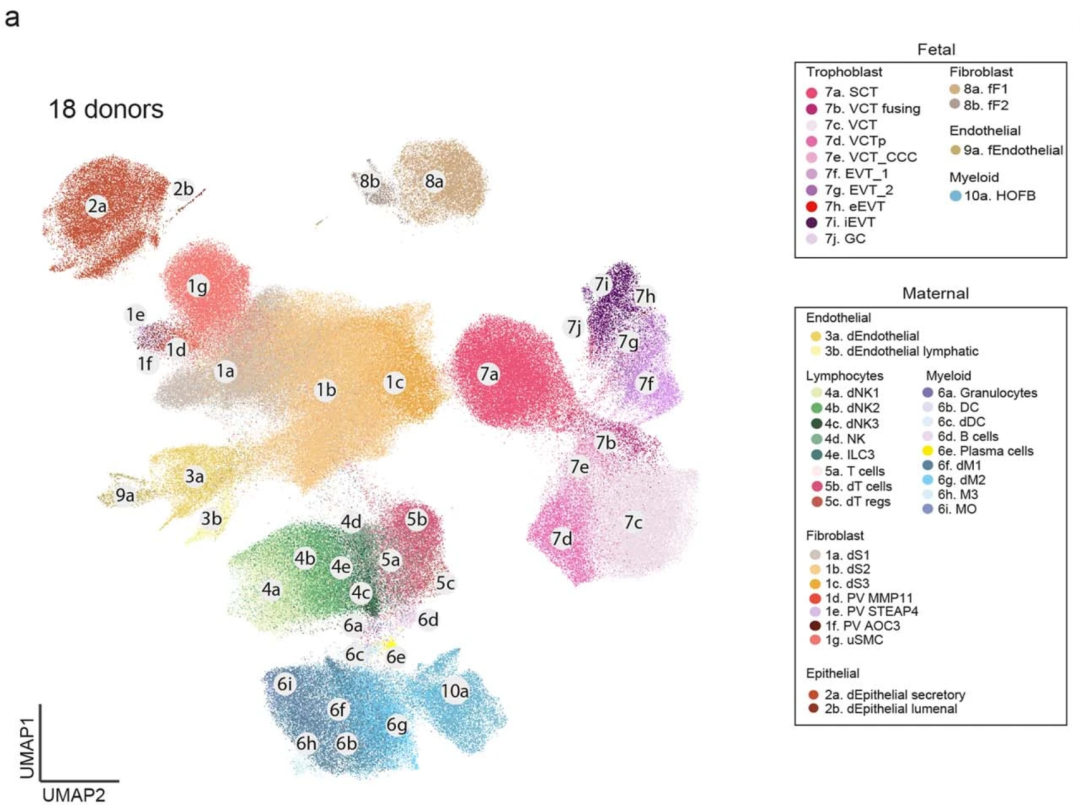
Arutyunyan等人论文中的扩展数据图11a。扩展数据图1c中描述的18名供体的母胎界面的单细胞RNA测序(scRNA-seq)和单细胞核RNA测序(snRNA-seq)数据的UMAP(均匀流形逼近与投影)散点图(n = 325,665个细胞和细胞核),按照细胞状态着色。图片来源:Arutyunyan A, et al. Spatial multiomics map of trophoblast development in early pregnancy. Nature 616: 143–151 (2023). doi: 10.1038/s41586-023-05869-0. (CC BY 4.0)
研究团队利用单细胞基因表达数据及CellPhoneDB v4等分析工具,研究了母胎界面中可能影响滋养层细胞浸润的配体-受体相互作用。他们观察到,CXCL16+CD14+ 蜕膜巨噬细胞和CXCR6+HLA-G+ EVT细胞之间的配体-受体相互作用能上调滋养层细胞中的胎盘基因,包括增加运动性的基因(2)。
他们还将部分存档组织块的组织切片置于Visium玻片上,通过Visium空间基因表达技术开展分析,并对同一张玻片上的胎儿(胎盘)和母体(蜕膜和子宫肌层)组织区域进行配对的形态学注释,包括来自P13供体的四张连续切片(2)。
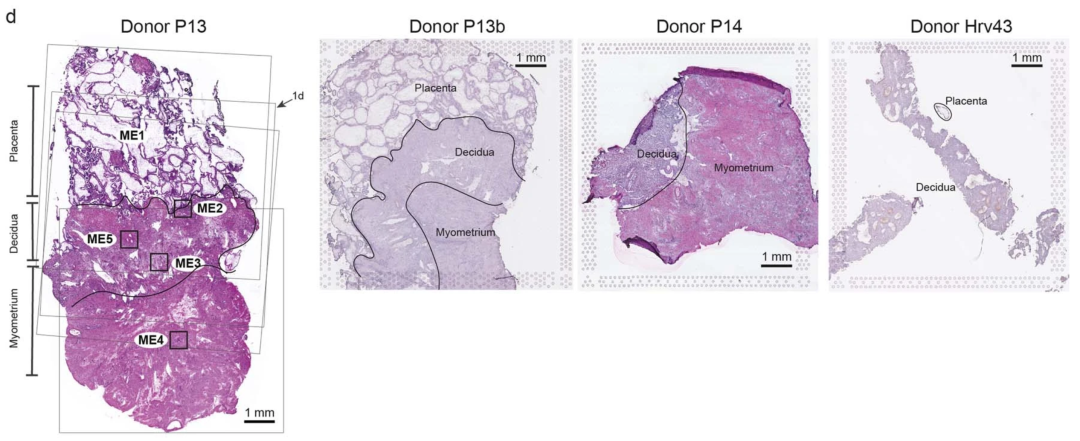
Arutyunyan等人论文中的扩展数据图1d。P13、P14和Hrv43供体组织的组织学概览(H&E染色)及组织区域注释。对于P13供体的着床部位(~ 8–9 PCW,左图),黑色方格(小)表示滋养层微环境的位置;浅灰色方格(大)表示组织在Visium空间转录组学捕获区中的定位;箭头表示图1d中进一步探索的代表性Visium切片。对于Visium分析,P13(n = 5个特征区域,4张存在位置重叠的连续切片和1张来自其他组织块P13b的切片)、P14(n = 2个特征区域,位置相同的连续切片)和Hrv43(n = 1个特征区域)。图片来源:Arutyunyan A, et al. Spatial multiomics map of trophoblast development in early pregnancy. Nature 616: 143–151 (2023). doi: 10.1038/s41586-023-05869-0. (CC BY 4.0)
利用cell2location等数据分析工具,研究团队整合了单细胞多组学和空间基因表达数据,以评估特定Visium数据点内的细胞状态密度。这项分析绘制出母胎界面的丰富空间图谱,反映出这个复杂而多变的结构内的独特细胞类型及其基因表达特征。
通过分析中获得的无偏全转录组数据,研究团队发现了母体螺旋动脉在着床后发生转化和堵塞的潜在细胞和分子机制。他们放大了浸润母体螺旋动脉的滋养层细胞的空间位置,观察到表达EFNB1的间质EVT细胞(iEVT)与表达同源受体基因EPHB6的母体血管周细胞之间存在配体-受体相互作用,后者可能会推动iEVT向动脉趋近(2)。研究团队还注意到血管内EVT细胞(eEVT)与组成母体血管的内皮细胞之间存在互补的配体-受体相互作用,eEVT在重建过程中会在螺旋动脉中形成堵塞(2)。
此外,研究团队还在动脉浸润的空间位置观察到细胞外基质组分的相互作用(包括COL21A1–ITGA2),以及Notch信号通路的激活,由配体基因(JAG1和JAG2)和受体基因(NOTCH2和NOTCH3)介导。目前已知Notch信号通路介导了血管生成过程中发生的细胞外基质重塑,这表明它们可能是介导母体动脉转化的重要信号通路(2,5)。
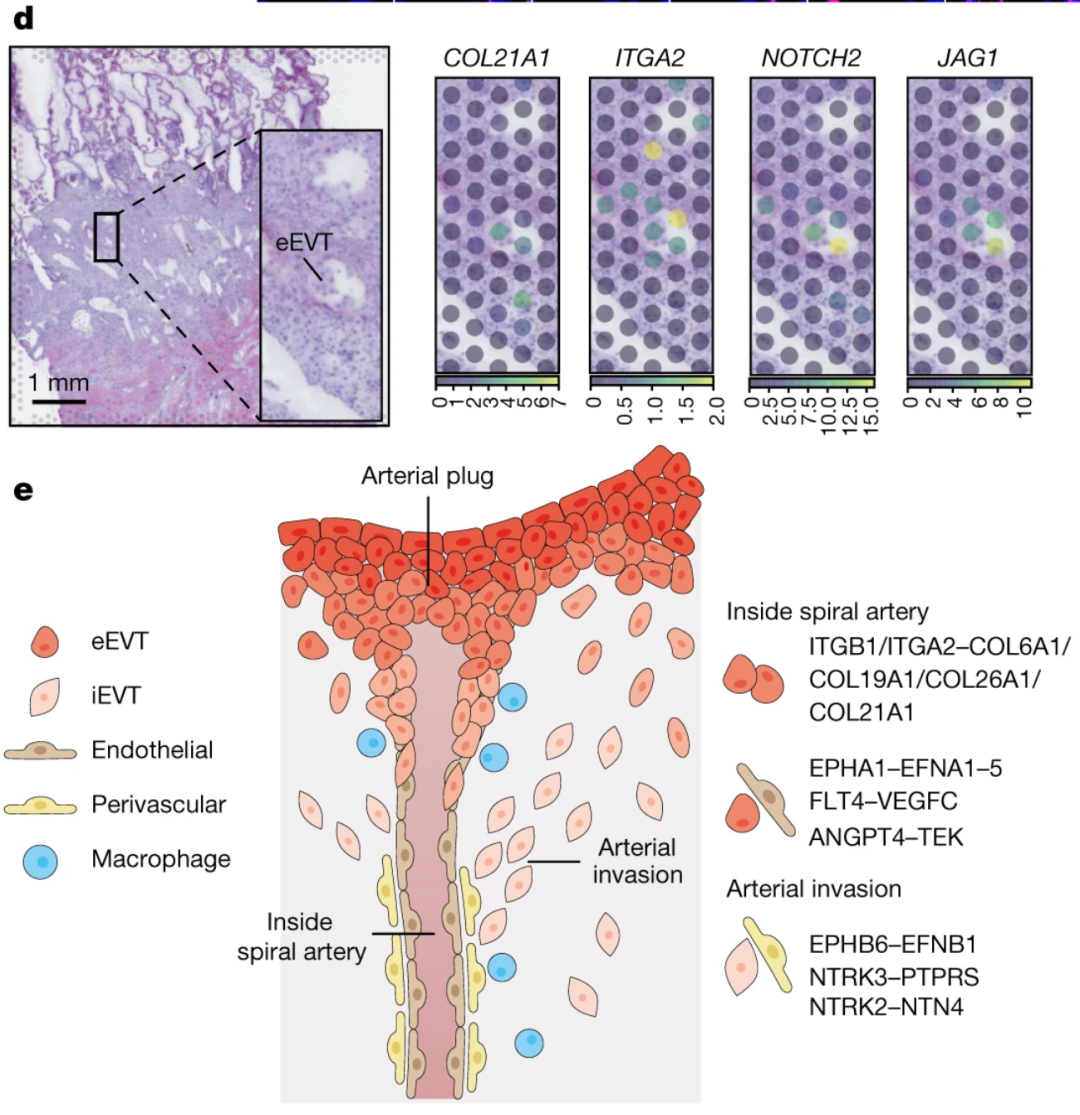
Arutyunyan等人论文中的图5d,e。d. 图中显示了P13供体组织的代表性切片的Visium空间转录组学数据中的浸润滋养层细胞状态的空间位置概览。捕获区的位置如扩展数据图1d中的箭头所示。数据点的颜色表示cell2location计算出的细胞状态密度,即Visium数据点中特定细胞状态的细胞数。e. 人类妊娠早期的螺旋动脉示意图,突出显示了血管周细胞(PV)-iEVT、内皮细胞-eEVT以及eEVT-eEVT之间的新型相互作用。图片来源:Arutyunyan A, et al. Spatial multiomics map of trophoblast development in early pregnancy. Nature 616: 143–151 (2023). doi: 10.1038/s41586-023-05869-0. (CC BY 4.0)
我们对人类妊娠和分娩的了解才刚刚起步
在女性健康的多个领域,包括妊娠,还有很多东西需要了解。不过,科学家们正在取得长足进步,他们应用高分辨率的单细胞和空间工具,绘制出人类成功生殖背后的特定细胞类型、细胞关系和信号通路。
“我们对生殖组织的基本了解一直滞后。如今随着这些新技术的应用,我们能够获得更多见解......这将对女性健康产生巨大的影响。”
Roser Vento-Tormo博士
Wellcome Sanger研究所细胞遗传学团队负责人
这些见解来自妊娠早期,正如本研究所示,也来自妊娠晚期,最近一篇发表在《Clinical and Translational Medicine》上的论文利用单细胞和空间转录组学来表征分娩过程中子宫肌层组织的免疫景观,包括有助于诱导分娩的炎症过程(6)。

对于这些团队为促进女性健康以及整个社会的健康和进步所做出的研究贡献,我们表示祝贺。
参考文献:
1. Levine N. Five things we know about the placenta—and a few we wish we did. Cedars Sinai Discoveries Magazine (Feb 12, 2021).
2. Arutyunyan A, et al. Spatial multiomics map of trophoblast development in early pregnancy. Nature 616: 143–151 (2023). doi: 10.1038/s41586-023-05869-0
3. Brosens I, et al. The “great obstetrical syndromes” are associated with disorders of deep placentation. Am J Obstet Gynecol 204: 193–201 (2011). doi: 10.1016/j.ajog.2010.08.009
4. https://www.mayoclinic.org/diseases-conditions/preeclampsia/symptoms-causes/syc-20355745
5. Kretschmer M, et al. Matrix stiffness regulates Notch signaling activity in endothelial cells. J Cell Sci 136: jcs260442 (2023). doi: 10.1242/jcs.260442
6. Ji K, et al. Integrating single-cell RNA sequencing with spatial transcriptomics reveals an immune landscape of human myometrium during labour. Clin Transl Med 13: e1234 (2023). doi: 10.1002/ctm2.123