
-

生物通官微
陪你抓住生命科技
跳动的脉搏
【值得关注的临床试验】单细胞和空间转录组学分析揭示抗体使转移瘤缩小的作用机制
【字体: 大 中 小 】 时间:2023年12月05日 来源:10x Genomics
编辑推荐:
在“值得关注的临床试验”系列文章中,我们将重点介绍单细胞多组学和空间基因表达在各个试验阶段的临床样本中的创新应用。
成功的临床试验有多种形式。有些临床试验发现了具有长期疗效的变革性疗法——比如2010年全球首次输注CAR-T细胞的案例(点击阅读相关报道),其中两名患有慢性淋巴细胞白血病的男性患者在数月后(以及接下来的10年中)病情得到缓解。这激励着研究人员去不断追求治愈疾病这一很难实现的目标,希望治愈癌症等广泛存在的疾病。人们最希望看到的试验结局是延长患者生存期,达到长期缓解,特别是在肿瘤学领域。
然而,即使是没有达到主要终点的临床试验,也能产生重要的生物学见解,并指导未来的药物发现工作。有了高分辨率的单细胞和空间转录组学工具,研究人员能够分析在整个试验过程中收集的患者样本,发现可预测治疗应答的稀有细胞群、改善患者分层的生物标志物或新的作用机制。
在“值得关注的临床试验”系列文章中,我们将重点介绍单细胞多组学和空间基因表达在各个试验阶段的临床样本中的创新应用。这些试验的目标各不相同,针对的复杂疾病也不相同,但它们共同展示了采用新方法来研究临床样本的价值,以及高分辨率见解在改善人类健康结局方面的可能性。
欢迎关注我们发布的系列文章,了解单细胞和空间工具如何应用于1-3期临床试验研究。
1期:一种可以有效缩小肿瘤体积并降低EMT评分的抗体
癌症类型:子宫内膜癌
疗法:利用netrin-1单克隆抗体(NP137)来阻断netrin-1,这是目前首个单药疗法
试验目标:评估安全性和有效性,并确定2期的推荐剂量
领导机构:法国里昂大学莱昂贝拉尔中心
合作制药公司:Netris Pharma
ClinicalTrials.gov注册编号:NCT02977195
netrin-1对癌症的发生和进展有什么意义,特别是子宫内膜癌?
有证据表明,当netrin-1与其受体结合时,会抑制p53依赖性的细胞凋亡,而在没有netrin-1干扰的情况下,p53通常会诱导癌细胞死亡并抑制肿瘤生长(1)。这项临床研究的作者还利用72个人类子宫内膜肿瘤样本证实,netrin-1在子宫内膜癌(EC)中显著上调,其主要受体在肿瘤组织中的表达高于健康的正常子宫内膜(2)。临床前EC小鼠模型和netrin-1阻断的数据进一步证实,靶向netrin-1可抑制肿瘤进展(2)。
临床结果:
14例晚期或转移性IV期子宫内膜癌(EC)患者接受了NP137治疗,每两周一次,总注射次数为2-17次(中位数为5.5次)。14人中有8人病情稳定,1人表现为部分缓解,6周时目标病灶缩小了51.16%,6个月后缩小了高达54.65%(2)。
单细胞和空间测序在该研究中的应用价值:
研究团队利用一名试验参与者治疗前和治疗后(经过两轮NP137后)的肺转移活检样本,分析了治疗对肿瘤组成和基因表达的影响。活检样本的单细胞RNA-seq分析结果表明,治疗后肿瘤细胞显著减少,上皮间质转化(EMT)的基因表达特征(通常与转移性扩增有关(3))也减少,这在批量细胞RNA-seq中也有所体现。有了单细胞分辨率的见解,研究人员就能自信地鉴定这些整体基因表达变化背后的细胞类型特异性事件,区分肿瘤和非肿瘤细胞活性,并发现可能因平均读数而遗漏的稀有细胞亚群。
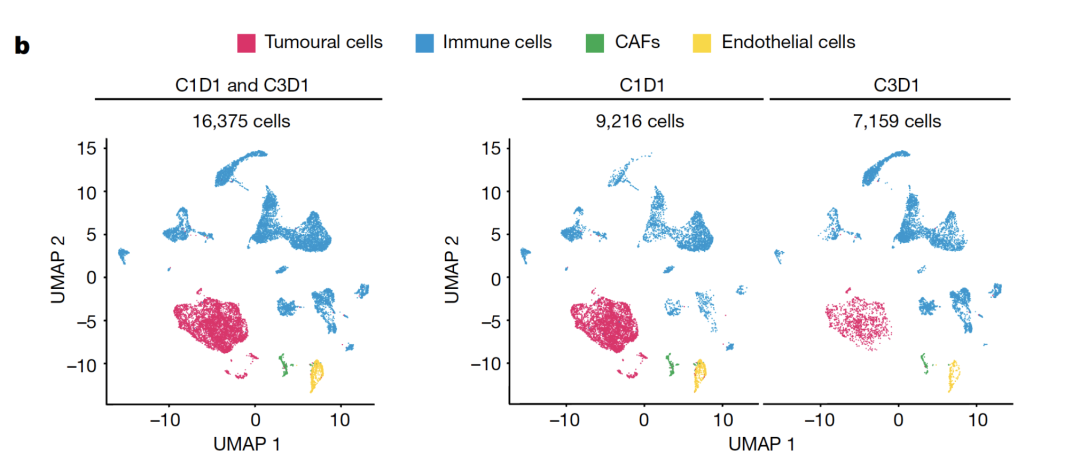
Cassier等人论文中的图4b显示了两个肺转移活检样本的16,375个细胞的UMAP图(左)。治疗前的样本包含9,216个细胞(C1D1,中),而治疗后的样本包含7,159个细胞(C3D1,右),按四种主要细胞类型着色。请注意,肿瘤细胞在治疗后出现减少。图片来源:Cassier P, et al. Nature 620: 409–416 (2023). doi: 10.1038/s41586-023-06367-z (CC BY 4.0).
为了进一步证实批量细胞数据中的EMT基因表达变化特异性地反映在癌细胞中,研究团队还利用Visium空间基因表达技术,对两例患者治疗前后的FFPE肿瘤切片进行分析。空间数据证实,在病理学家标出的肿瘤区域,EMT特征在治疗后下降。
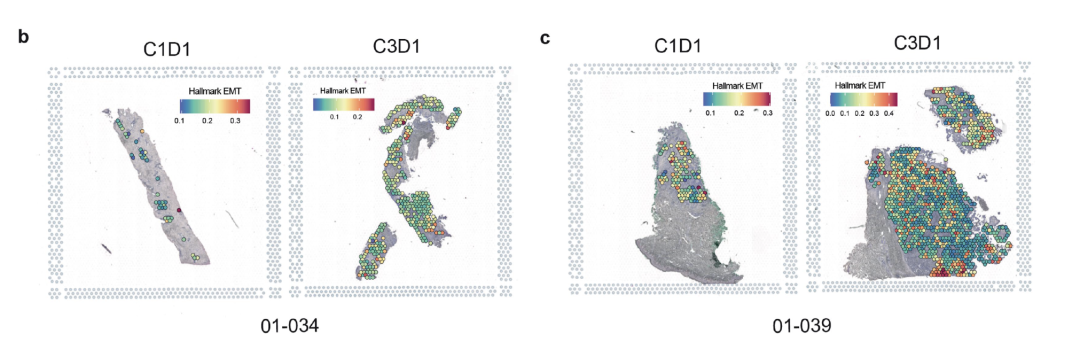
Cassier等人论文中的扩展数据图3b,c显示了两例患者(01-034和01-039)治疗前后的配对样本上的Visium空间数据。Visium肿瘤数据点上显示了EMT评分。图片来源:Cassier P, et al. Nature 620: 409–416 (2023). doi: 10.1038/s41586-023-06367-z (CC BY 4.0).
免疫群体也受到了NP137治疗的影响。单细胞数据显示,细胞毒性CD8+ T细胞和自然杀伤细胞的数量增加,而且单细胞和空间数据均显示,T细胞与肿瘤细胞之间相互作用的数量和强度有所增加(通过CellChat分析确定)。这一发现为NP137治疗后抗原呈递更高效补充了证据,正如单核细胞转变为树突状细胞与癌细胞相互作用所显示的(2)。
有了单细胞和空间转录组学带来的见解,NP137的效果将受到越来越多的关注。作者在注意到NP137对EMT特征以及下游的肿瘤细胞组成和相互作用变化的影响后,提出了一种潜在的作用机制:NP137可能通过减少EMT特征来增强肿瘤免疫应答。目前仍缺乏缓解肿瘤EMT的治疗方案,但这一证据表明,NP137可与其他常规疗法联合使用,以解决这一尚未满足的临床需求(2)。
参考资源:
Arakawa H. Netrin-1 and its receptors in tumorigenesis. Nat Rev Cancer 4: 978–87 (2004). doi: 10.1038/nrc1504
Cassier P, et al. Netrin-1 blockade inhibits tumour growth and EMT features in endometrial cancer. Nature 620: 409–416 (2023). doi: 10.1038/s41586-023-06367-z
Roche J. The epithelial-to-mesenchymal transition in cancer. Cancers (Basel) 10: 52 (2018). doi: 10.3390/cancers10020052