
-

生物通官微
陪你抓住生命科技
跳动的脉搏
病原生物学研究所崔胜团队揭示新型冠状病毒拮抗宿主天然免疫的结构基础
【字体: 大 中 小 】 时间:2023年03月25日 来源:北京协和医学院
编辑推荐:
病原生物学研究所崔胜团队于2021年5月14日在Nature Communications上发表题为《Crystal Structure of SARS-CoV-2 Orf9b in Complex with Human TOM70 Suggests Unusual Virus-Host Interactions》的论文
由新型冠状病毒(SARS-CoV-2)感染引起的新冠肺炎(COVID-19)的感染人数和死亡人数还在持续攀升,对全球经济和公共卫生带来前所未有的挑战,目前尚无特效的抗新冠病毒药物,新药物、新靶点的研发势在必行。除病毒自身靶点之外,寻找有效的宿主靶点逐渐成为药物研发的新趋势。冠状病毒不但编码结构蛋白和非结构蛋白,还具有一套独特的“辅助蛋白”。辅助蛋白并非病毒复制必须的蛋白质,但它们对冠状病毒在细胞中的生存至关重要。辅助蛋白参与天然免疫的调节,促进病毒感染。SARS-CoV-2感染的特征之一是IFN-I的诱导被抑制,这归功于辅助蛋白对IFN-I信号通路的干扰。有证据表明:SARS-CoV-2辅助蛋白Orf9b能够与锚定在线粒体膜的多功能接头蛋白TOM70结合,从而抑制抗病毒天然免疫反应。
病原生物学研究所崔胜团队于2021年5月14日在Nature Communications上发表题为《Crystal Structure of SARS-CoV-2 Orf9b in Complex with Human TOM70 Suggests Unusual Virus-Host Interactions》的论文。依赖X射线晶体衍射技术,SARS-CoV-2 Orf9b/TOM70复合物结构的分辨率大幅提升至2.2?。在高分辨率三维结构的帮助下,研究人员不但更精确地揭示了Orf9b-TOM70相互作用的结构基础,而且发现,SARS-CoV-2 Orf9b通过占据TOM70 CTD口袋改变NTD的构象,从而别构抑制TOM70 NTD与Hsp90蛋白的结合。这些发现有力支持了Orf9b通过结合TOM70干扰Hsp90-TOM70相互作用,最终抑制IFN-1信号通路的假说。
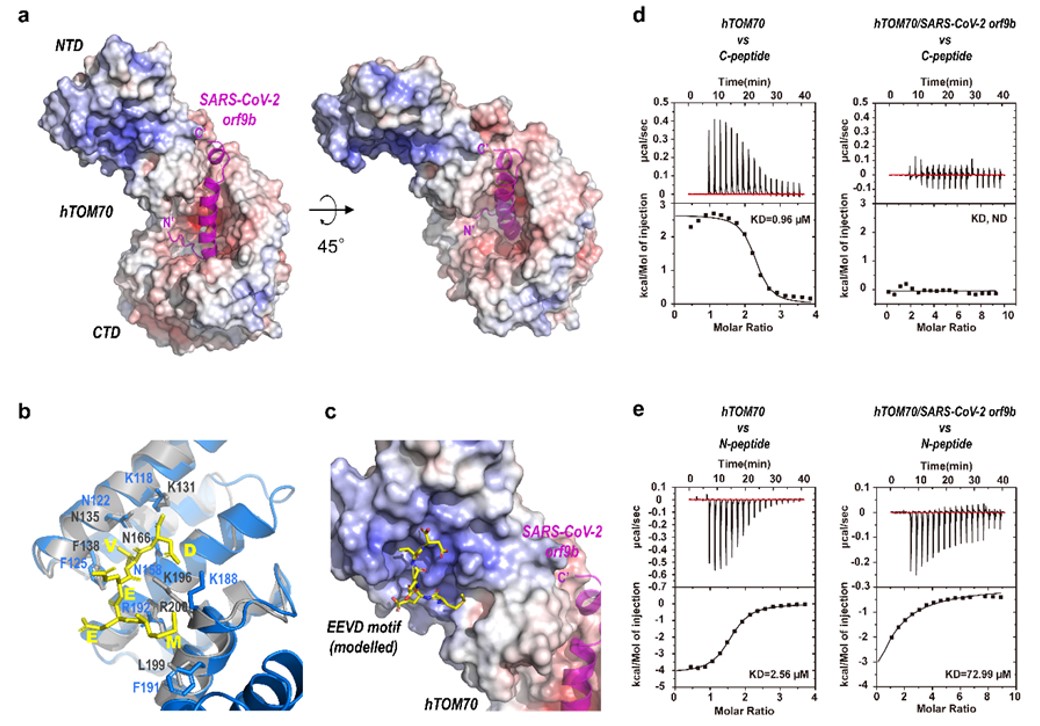
图:SARS-CoV-2辅助蛋白Orf9b与宿主蛋白TOM70的复合物晶体结构
及Orf9b的别构抑制机制
病原所崔胜研究员为本文的通讯作者,崔胜课题组副研究员高小攀博士、博士生朱凯翔和主管技师秦博为本文的共同第一作者。本研究得到中国医学科学院医学与健康科技创新工程(2017-I2M-1-014和2016-I2M-1-013)、国家重点研发专项(2018ZX10101001)等项目的资助。
论文链接:https://www.nature.com/articles/s41467-021-23118-8
文图|病原生物学研究所