
-

生物通官微
陪你抓住生命科技
跳动的脉搏
PNAS:lncRNA驱动Notch信号调控恶性肿瘤转移的新机制和干预新策略
【字体: 大 中 小 】 时间:2023年03月28日 来源:浙江大学生命科学学院
编辑推荐:
2023 年 2 月 17 日,浙江大学生命科学学院遗传与再生生物学研究所林爱福课题组在 PNAS 杂志( Direct submission )在线发表题为 lncRNA BREA2 promotes metastasis by disrupting the WWP2-mediated ubiquitination of Notch1 的研究论文
包括乳腺癌在内的恶性肿瘤转移长期作为人类临床干预的重大挑战,严重危害肿瘤病患生命健康。目前越来越多研究表明,在肿瘤转移进程中,原发肿瘤经历了动态渐进的分子事件及表型变化,从而推动其从局部组织扩散、内渗进入循环系统中存活,后续通过外渗迁出循环系统,继而进入远处组织并最终引发转移灶。深入解析肿瘤转移节点环节中的节点分子和细胞事件,将为恶性肿瘤临床干预提供思路借鉴。
Notch信号作为控制细胞生长分化和命运决定的重要信号,其调控失衡与人类重大疾病关联,包括T细胞急性淋巴细胞白血病(T-ALL),慢性淋巴细胞白血病,乳腺癌和结肠癌等。哺乳动物Notch信号传导是由邻近细胞之间的受体-配体相互作用启动,Notch受体激活导致其细胞内结构域(NICD)易位到细胞核中以诱导下游靶基因转录事件的发生,Notch信号的终止或可通过NICD的蛋白酶体依赖性降解进行调节。然而细胞核中NICD稳定性调节很大程度上仍缺乏深入理解,深入解析Notch降解机制将为肿瘤临床诊断治疗提供潜在新靶点和新策略。目前临床上已经开发了几种临床试验评估阶段的Notch靶向治疗方法,例如针对Notch配体和受体的单克隆抗体以及小分子γ分泌酶抑制剂(GSI),然而对部分携带Notch激活突变的癌症均收效甚微,同样进一步暗示其中转录调控激活分子事件的机制复杂性和认知紧迫性。
长链非编码RNA(lncRNAs)作为一类长度大于200nt的非编码RNA,在信号转导、细胞代谢和肿瘤发生等进程中发挥重要调控作用。近年来,浙江大学林爱福课题组在上述研究取得了系列研究进展,揭示了细胞膜脂结合LINK-A促进质膜PIP3-AKT信号转导,细胞质CamK-A调控Ca2+依赖性激酶活性重塑肿瘤微环境,细胞器-线粒体定位GAS5和溶酶体定位SNHG6的区室化动态分布调控细胞代谢进程。深入阐明lncRNAs作为新型调控元件在信号转导和肿瘤发生的机制功能,将为深入揭示并有效干预肿瘤等重大恶性疾病提供理论参考和临床借鉴。
2023年2月17日,浙江大学生命科学学院遗传与再生生物学研究所林爱福课题组在PNAS杂志(Direct submission)在线发表题为lncRNA BREA2 promotes metastasis by disrupting the WWP2-mediated ubiquitination of Notch1的研究论文。该研究发现lncRNA BREA2通过抑制E3泛素化连接酶WWP2与NICD1核内互作,从而引起Notch下游转录激活事件,最终导致乳腺癌恶性肺部转移发生。该发现填补了长久以来对非突变依赖性Notch细胞核活化调控机制的研究认知,研究开发基于靶向RNA的核酸药物治疗策略也为后续肿瘤临床治疗提供了潜在干预靶点和策略。
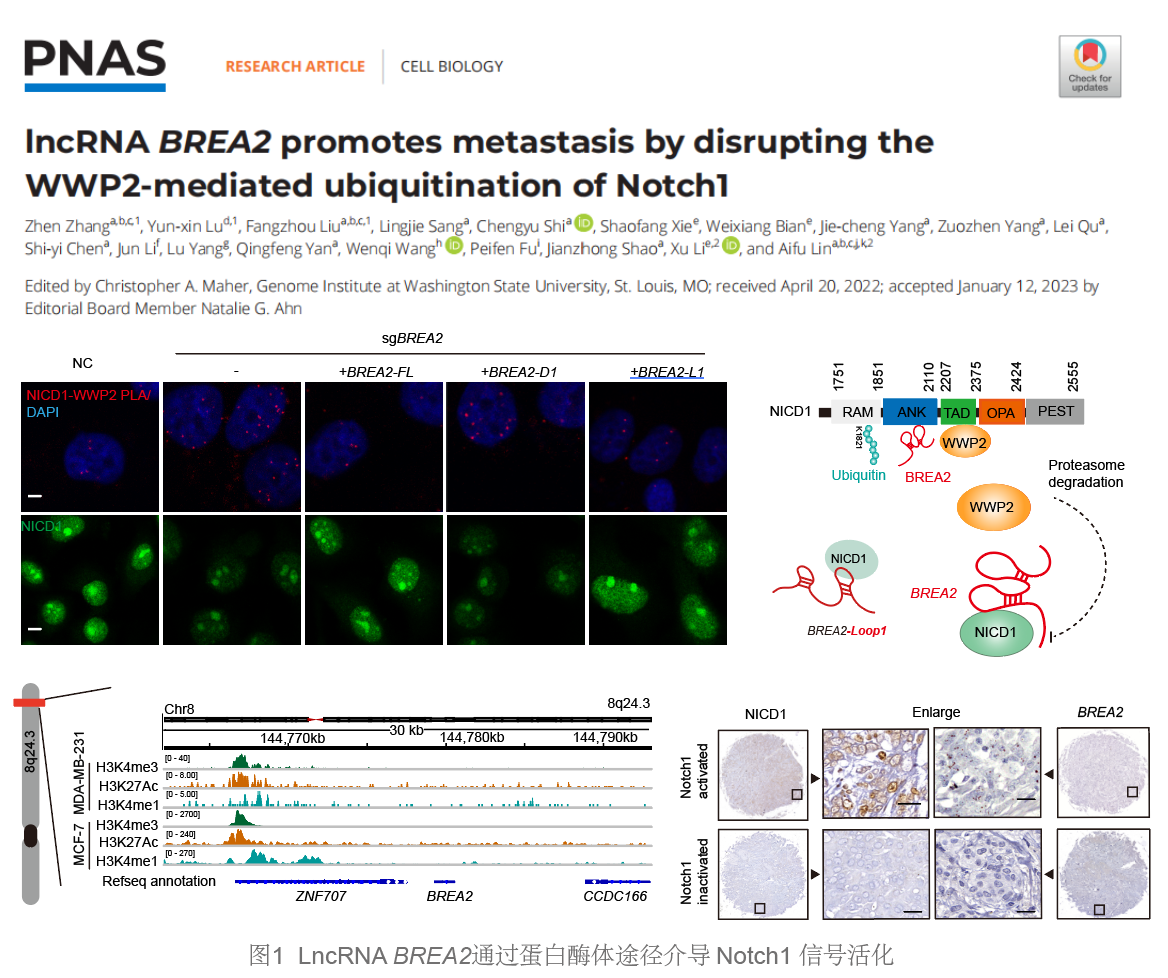
研究人员通过构建乳腺癌转移动物疾病模型,发现其中乳腺癌肺转移灶中高表达的lncRNA BREA2主要分布于细胞核,能够特异性激活Notch信号,并与乳腺癌不良预后显著相关。进一步,研究人员利用高通量蛋白质组学技术解析了细胞核内与BREA2互作的节点调控分子,发现BREA2直接结合Notch1的胞内结构域NICD1并抑制其蛋白水平降解。随后,通过深入解析BREA2调控Notch1降解机制,发现BREA2能够抑制NICD1与E3泛素连接酶WWP2的细胞核内互作。在此基础上,研究人员进一步解析了BREA2-NICD1-WWP2复合体的分子调控机制,发现BREA2结合在NICD1 的ANK 结构域并拮抗结合在相邻结构域TAD的WWP2对NICD1K1821的泛素化,抑制WWP2对NICD1的泛素化降解,增强其下游转录激活并加速乳腺癌细胞转移进程。上述发现揭示了BREA2通过拮抗泛素连接酶WWP2对NICD1的互作调控,促使核内NICD蛋白稳定积累,从而驱动Notch信号异常激活,最终导致肿瘤恶性转移的全新调控机制。
进一步,研究人员利用乳腺癌原位荷瘤小鼠模型研究BREA2在乳腺癌肺转移过程中的体内调控功能,发现过表达BREA2拮抗WWP2介导的Notch信号失活,加速小鼠乳腺癌细胞从乳腺癌原位到肺部组织的转移进程。在此基础上,研究人员通过开发靶向RNA的核酸小分子药物抑制剂并结合乳腺癌PDX模型,发现敲低乳腺癌病人组织来源PDX模型中的BREA2能够显著抑制了乳腺癌的发生发展。此外,研究人员进一步发现敲低BREA2联合Notch抑制剂GSIs,能够极大协同抑制乳腺癌肺部转移进展,上述发现为临床肿瘤诊断治疗提供新靶点和新策略。
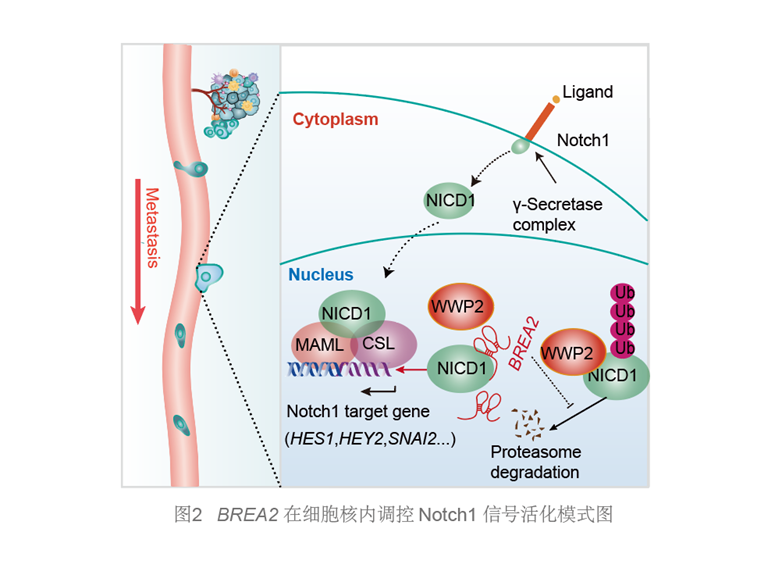
综上,该研究解析了细胞核lncRNA介导Notch1激活的肿瘤转移调控全新机制,为深入揭示lncRNA调控细胞稳态与疾病恶变、肿瘤转移节点分子事件及Notch1转录调控激活机制等提供了理论参考,也为针对肿瘤恶性转移的临床干预提供了潜在借鉴。
浙江大学生科院博士生张祯、刘方舟与中山大学肿瘤防治中心鲁运新博士为论文的共同第一作者,通讯作者为林爱福教授和西湖大学的李旭教授。研究工作也得到了邵建忠教授、严庆丰教授和傅佩芬教授等合作者的大力支持。目前该团队欢迎对RNA生物医学、肿瘤生物学方向感兴趣的青年才俊加盟(提供博士后及特聘研究员、副研究员等岗位)。
原文链接:https://www.pnas.org/doi/10.1073/pnas.2206694120