-

生物通官微
陪你抓住生命科技
跳动的脉搏
一招分辨磷酸化蛋白or总蛋白----LI-COR Odyssey帮您来实现
【字体: 大 中 小 】 时间:2023年05月12日 来源:
编辑推荐:
文中作者使用不同荧光基团标记的二抗,同时检测了磷酸化蛋白水平和该蛋白的总水平,无需进行剥离及再孵育,大大缩短了磷酸化蛋白检测的时间,实现了高效便捷的磷酸化蛋白水平和该蛋白的总水平检测。
什么是蛋白质磷酸化?
蛋白质磷酸化是在蛋白质激酶催化下,把ATP的磷酸基转移到底物蛋白质氨基酸残基(丝氨酸、苏氨酸、酪氨酸)上,使蛋白质构象发生改变,产生活性进而行使功能的过程。而磷酸化的蛋白在蛋白磷酸酶的作用下又可以去磷酸化,整个过程是可逆的。
蛋白质磷酸化有什么用?
蛋白质的磷酸化和去磷酸化是可逆性调节蛋白质功能的重要方式,几乎涉及所有生理、病理过程,如细胞的生长发育、基因表达与调控、神经递质的合成与释放,甚至细胞癌变等。通过蛋白质的磷酸化与去磷酸化,细胞控制着信号的传递过程,进而影响细胞的生物学效应与功能,在生命活动中发挥着重要作用。
蛋白质磷酸化如何检测?
在进行蛋白质磷酸化Western Blot分析检测时,需要同时检测磷酸化蛋白水平和该蛋白的总水平,但两者分子量差距很小,使用化学发光方法进行检测时,需要先使用磷酸化蛋白抗体进行孵育、检测,之后进行剥离,再重新孵育该蛋白的抗体进行检测。
既然化学发光Western Blot检测法检测磷酸化蛋白这么麻烦,那有没有什么方法可以实现磷酸化蛋白快速便捷的检测呢?

作者Xiomaris M. Cotto-Rios等利用LI-COR Odyssey 进行Western Blot,检测了目的蛋白(抗原/抗体)是否表达、表达的特异性、表达量的高低。文中作者使用不同荧光基团标记的二抗,同时检测了磷酸化蛋白水平和该蛋白的总水平,无需进行剥离及再孵育,大大缩短了磷酸化蛋白检测的时间,实现了高效便捷的磷酸化蛋白水平和该蛋白的总水平检测。由于药物筛选实验的高通量性,本文还用到了LI-COR In cell western(无需裂解细胞、制胶、上样、跑胶、转膜等步骤,直接在96孔/384孔板进行点Western Blot),进行高通量的Western Blot蛋白定性定量分析。

In-cell western 技术优势
1、省时,直接在微孔板检测,无需细胞裂解、跑胶和转膜等过程;
2、高通量,一次可实现6*96/384个样品检测;
3、数据变异小,直接对细胞内的蛋白进行检测,特异性好,灵敏度高;
4、双通道同时检测,不同荧光标记二抗同时检测两个蛋白

文章研究背景
BRAF激酶是众所周知的ERK信号通路的关键效应因子,在许多癌症中被过度激活。然而在许多肿瘤中,BRAF二聚体也会介导ERK信号传导。因此有些FDA批准的RAF抑制剂对BRAF二聚体的抑制效果不佳,从而也会导致肿瘤的耐药性。Ponatinib(普纳替尼)是FDA批准的药物,是BRAF单体和二聚体的有效抑制剂,Ponatinib可结合BRAF二聚体,并通过与先前未发现的变构位点相互作用来稳定一个独特的αC-螺旋构象。基于上述已在结构方面取得的研究成果,接下来要介绍的这篇文章,作者研究开发了一种新的BRAF抑制剂—PHI1,与Ponatinib都将更有助于对BRAF依赖性肿瘤的治疗。
部分数据展示
RAF二聚体激酶抑制剂的筛选
首先为了实现对RAF二聚体激酶抑制剂的鉴定,作者使用SKMEL239-C4黑素瘤细胞建立了基于In cell western筛选的测定方法(见下图a、b)。在 Vemurafenib(维莫非尼,BRAF选择性抑制剂)诱导的抑制BRAF的选择压力下,允许表达p61BRAF(p61BRAF对Vemurafenib病毒有抗药性,可在患者的肿瘤中发现)的细胞优先生长,即这类细胞可产生BRAF的剪接突变体,其以不依赖于RAS的方式通过二聚体形式进行信号通路转导。对未经药物处理或用增加浓度的 Vemurafenib处理过3小时的SKMEL239-C4细胞,测定其细胞内的蛋白磷酸化水平。微孔板的In cell western图像显示的是细胞中磷酸化ERK1(绿色)和总ERK1(红色)的荧光抗体孵育后的表达情况及其合并图像(图2c)。基于磷酸化ERK (p-ERK)和总ERK荧光读数的 In cell western ,检测到的信号动态范围广泛,并且在低浓度的 Vemurafenib下重现了SKMEL239-C4细胞的p-ERK 抗性。相反,Trametinib,一种FDA批准的MEK抑制剂,在低nM浓度下有效地抑制ERK信号传导(图2e)。作者使用具有非抑制浓度的Vemurafenib作为阴性对照和0.1μM Trametinib阳性对照的96孔格式,获得0.68的Z因子(图2f)。作者发现 ,Ponatinib是一种有效的BRAF抑制剂,具有与其他RAF抑制剂相似的效力。
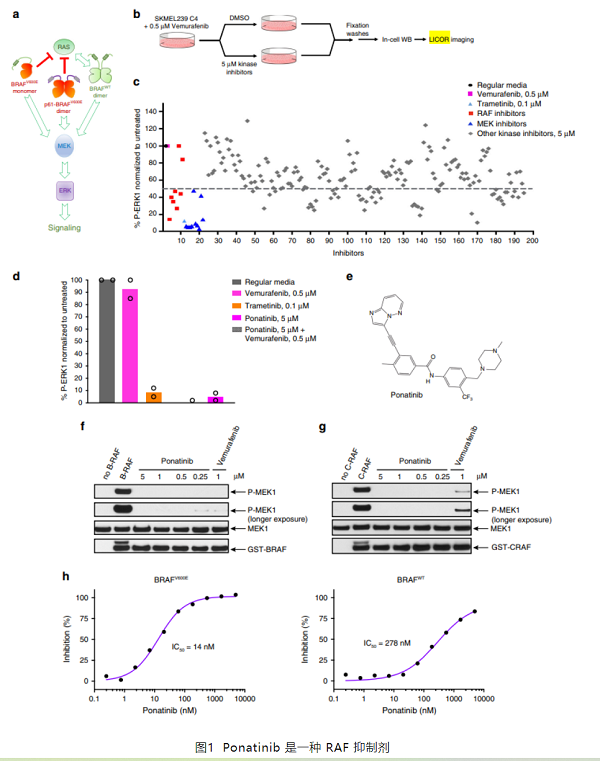
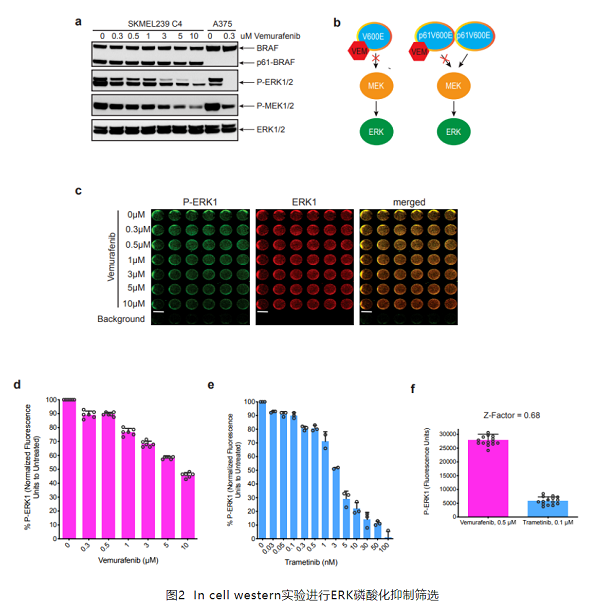
Ponatinib能有效抑制致癌性BRAF
接下来,检测Ponatinib依赖于BRAFV600E,p61BRAFV600E和 RASMUT/BRAFWT的ERK信号传导抑制肿瘤细胞的能力。为了与BRAFV600E单体的有效抑制剂进行比较,作者使用了Vemurafenib。Ponatinib在0.3-0.5μM的剂量下抑制BRAFV600E和p61BRAFV600E依赖性黑素瘤细胞中的ERK信号传导。然而,需1-3μM的剂量才能有效抑制RASMUT/BRAFWT黑素瘤或肺癌细胞中的信号传导,这表明由于RAF引发的一些抗性与其他αC-IN 抑制剂类似(图3a)。
Ponatinib抑制ERK信号传导而不降低SKBR3细胞中的RASWT-GST水平,而Lapatinib抑制ERK信号传导并如预期的那样显著降低RASWT-GST水平(图3b)。

用设计的抑制剂开发BRAF变构部位
基于对Ponatib-BRAFV600E 二聚体结构的认识,进一步开发已鉴定的BP-IVallosteric位点。通过KinomeEDGE筛选和SelectScreen等研究结果表明,BRAF构象的特异性结构变化以及PHI1与αCallosteric位点的相互作用导致PHI1对BRAF对其他激酶的特异性增加。
最后,评估PHI1对肺腺癌H2087和H1666细胞以及由RASMUT/BRAFWT驱动的SKMEL-2和SKMEL-30黑素瘤细胞系的抑制作用。在非康奈非尼处理的细胞中,检测到PHI1的低p-ERK抑制(图5a,b)。相比之下,在康奈非尼预处理后,PHI1在H2087和H166肺癌细胞系中均表现出亚微摩尔p-ERK抑制,在H2087中具有更显著的作用(图4a,b)。综上所述,这些结果表明PHI1对BRAF二聚体的第二位点具有独特的特异性,并且在不同类型的BRAF抑制剂之间具有明显的正协同抑制机制。

LI-COR Biosciences公司在近红外荧光成像领域已有25年的积淀。
25年来,LI-COR Odyssey®双色红外激光成像系统由于可实现Western Blot精确定量,多重Western Blot检测,且重复性更高,通量更高,拥丰富的应用范围,因而得到了全球生物医学研究人员的信赖。
丰富的多功能应用