
-

生物通官微
陪你抓住生命科技
跳动的脉搏
看空间转录组学如何推动癌症药物发现
【字体: 大 中 小 】 时间:2023年05月15日 来源:10x Genomics
编辑推荐:
空间转录组学的出现让研究人员能够在天然结构下观察生物标志物、空间相互作用和肿瘤转录组,帮助他们更好地鉴定潜在的药物靶点和耐药机制。
受到栖息在加拉帕戈斯群岛上的各种雀鸟启发,查尔斯·达尔文(Charles Darwin)提出了进化论。达尔文雀从数百万年前来到群岛的单个物种进化而来。它们最独特的特征是有着各种各样的鸟喙,每一种都完全适合它们的食物偏好,这是几个世纪自然选择后的结果。
复杂人类肿瘤内的异质细胞也像加拉帕戈斯群岛上的达尔文雀一样——即使是采用最积极的治疗,适应性最强的细胞也能生存下来。不过,肿瘤内自然选择的结果似乎是在一夜之间出现,让治疗从有希望变成不起作用。
高度异质性的肿瘤从自然选择中获益,却对患者造成伤害。这些肿瘤具有高度适应性,往往耐受靶向治疗。需要新型疗法或组合疗法才能有效治疗这些不断进化的肿瘤。
不过,在实验室里再现高度异质性的肿瘤却是很困难的。肿瘤的异质性不仅仅涉及到细胞间变化。肿瘤周围的环境,包括浸润的免疫细胞和血管,也会影响肿瘤的生长、恶性程度和耐药性。特定癌症的小鼠模型(包括人源性肿瘤异种移植)往往无法完全再现肿瘤内部和周围的异质性(1,2)。
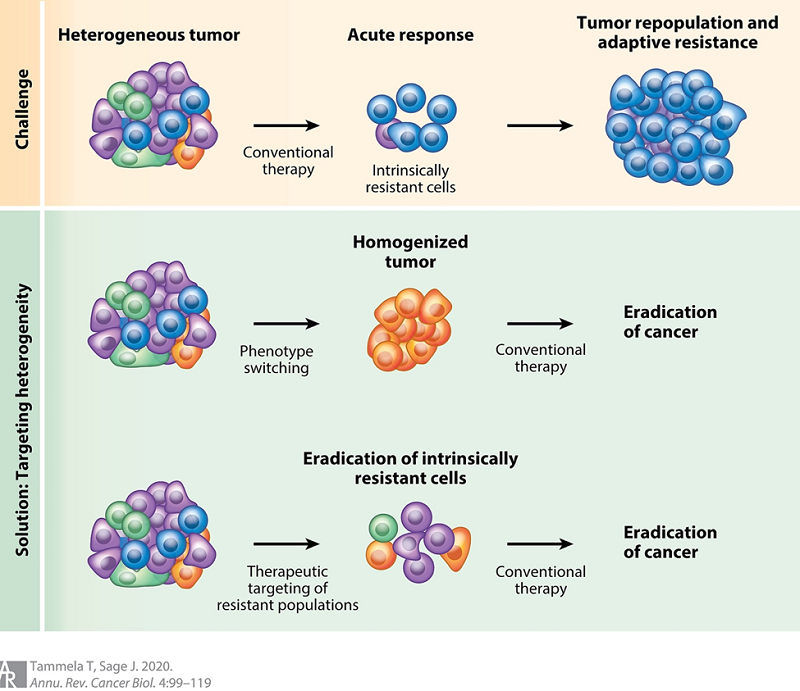
图1. 自然选择让高度异质性肿瘤的治疗变得更复杂。肿瘤内的固有耐药细胞往往在治疗中存活下来,迅速形成高度耐药的肿瘤。若要对异质性肿瘤进行有效治疗,必须在常规治疗前通过靶向治疗来清除耐药细胞。治疗策略包括通过表型转换或专门清除耐药细胞来促使细胞产生应答(Tammela T and Sage J. Annu Rev Cancer Biol 4: 99–119 (2020).)。
直击源头是描述肿瘤异质性有何影响的最佳方式,而单细胞RNA测序(scRNA-seq)正是这么做的。scRNA-seq改变了研究人员探究患者样本中肿瘤异质性影响的方式,并提供了一些重要信息,说明肿瘤及其微环境中惊人的细胞和遗传多样性(3)。不过,scRNA-seq使用新鲜或固定的细胞或细胞核,需要组织解离,这就破坏了细胞间的相互作用和肿瘤微环境(TME)。
空间转录组学的出现让研究人员能够在天然结构下观察生物标志物、空间相互作用和肿瘤转录组,帮助他们更好地鉴定潜在的药物靶点和耐药机制。研究人员已利用我们的Visium空间基因表达技术开发出适用于肿瘤学药物发现的可再现工作流程,并通过治疗后患者肿瘤样本的研究确定了耐药和复发的机制。
探索癌症的群岛
百时美施贵宝公司的研究人员近日发表了试验性数据,证明空间转录组学能够准确捕获高度异质性肿瘤TME中的各个区室和相互作用,不仅适用于新鲜或冷冻组织,还适用于FFPE样本——这是长期保存的患者来源肿瘤样本的最常见形式(4)。
他们采用Visium空间基因表达分析了40个新鲜和冷冻组织样本,包括来自小鼠肿瘤模型的组织(有着复杂的TME)和来自患者肿瘤的组织(具有不同程度的异质性)。最终,他们不仅准确捕获了高度复杂肿瘤的结构和空间位置,还鉴定出推定的肿瘤标志物。
制药研究团队开发出一个空间验证框架(spatial validation framework),这个正交的验证框架整合了基因表达和数字病理学数据。他们用这个框架来验证表达数据的分布,并使用数字病理学注释来解释数据,以此来指导生物标志物发现和靶点验证。
他们利用神经网络生成了一个深度学习模型,对H&E染色后的组织样本的形态进行注释,并与空间转录组学数据相结合——病理学家验证了这些注释。为了与Space Ranger、Seurat v4及其他R语言包处理的空间转录组学分析相结合,他们将每个数据点分配到与之重叠最多的数字病理学所定义的组织区室中。这种共定位分析帮助研究团队验证了不同组织区域内的已知标志物和细胞类型,并鉴定出与临床相关的新型标志物和受体-配体对。
研究人员首先使用这个工作流程,利用Visium空间基因表达和数字病理学分析了从健康大鼠中分离出的新鲜冷冻结肠组织样本。他们微调了成像方法的细节,确认了空间转录组学分析获得的基因表达谱与小鼠结肠组织中结构清晰的区室和充分鉴定的稀有细胞类型的标志物基因相匹配。此次分析捕捉到了上皮等特征区室以及肠道神经元等稀有细胞的基因表达谱。
他们的分析也准确展现了肿瘤组织结构。研究团队通过有监督的数字病理学分析了H&E染色后的组织切片,鉴定出八个不同的图像纹理或区室,包括隐窝。通过空间转录组学分析鉴定出的de novo基因表达聚类与之前报道的预计在各个区室中出现的细胞类型的生物标志物一致。
不过,他们的最终目标是证明空间转录组学能够有效地描绘复杂且异质性的癌症组织,并获得新见解。研究人员利用大鼠和患者的肿瘤样本来证明,空间转录组学分析能够始终如一地鉴定高度异质性肿瘤组织中的推定生物标志物和成对相互作用。
例如,他们分析了人源性胰腺导管腺癌(PDAC)肿瘤的FFPE组织切片,并鉴定出几个已知的肿瘤固有的生物标志物(包括MIF,一种调节炎症以协助肿瘤免疫逃逸的配体)和PDAC相关的成对相互作用,比如促进肿瘤发生的CXCR4及其配体CXCL12的过表达。总的来说,作者为其他研究团队绘制了一张地图,方便他们探索癌症样本并获得对癌症及潜在疗法的新见解。
这个研究团队还开发出一个名为BMS Spatial Portal的可视化应用程序,以支持对空间基因组学数据的探索。通过这个站点,其他人可以探索研究中收集的基因表达和生物标志物数据,并利用文献中描述的方法来分析他们生成的数据。
评估自然选择的影响
另一组来自约翰霍普金斯大学医学院的研究人员对肿瘤切除物开展了Visium空间基因表达分析,以确定应答情况不同的肝细胞癌(HCC)患者肿瘤内的临床相关差异,有些患者在1b期临床试验中对新辅助疗法cabozantinib(一种阻断VEGF的抗血管生成疗法)和PD-1抑制剂nivolumab(CABO/NIVO)有应答,有些则无应答(5)。
HCC是原发性肝癌的最常见形式,而肝癌是2020年癌症死亡的第三大原因(6)。抗血管生成和免疫检查点抑制剂(主要是PD-1抑制剂)的联合治疗是目前对抗HCC的标准做法,但对许多患者不起作用,即使有些患者最初的应答状况良好,但后来还是会复发。不幸的是,目前还没有已知的生物标志物来区分应答者和无应答者。
约翰霍普金斯大学医学院的研究人员希望改变这一状况。他们最近开展了一项1b期临床试验,招募了在手术切除前接受了八周CABO/NIVO治疗的患者(7)。在招募的15名患者中,五名患者出现明显病理缓解(可见90%或以上的肿瘤坏死)。这五名应答者的肿瘤切除术显示免疫浸润增加,且免疫抑制性巨噬细胞的数量减少。
研究团队想了解哪种选择性压力让这些肿瘤对CABO/NIVO治疗更敏感,并找到可以预测患者应答的生物标志物。他们认为,深入挖掘其数据的最佳方式是利用Visium空间基因表达技术开展高分辨率的空间分析。
“近期兴起的一些提供空间可辨的基因表达数据的技术为分析TME引入了强大的方法,并有助于了解肿瘤内在的特征与对肿瘤形成和治疗应答很关键的其他细胞类型的分布有何关联,”作者谈道(5)。
他们通过无监督聚类分析了七个冷冻的HCC手术样本(包括四名应答者和三名无应答者)的空间转录组学数据,并确定了HCC肿瘤中常见的细胞群,包括癌细胞、癌症相关成纤维细胞和免疫细胞。一位病理学家通过组织学分析证实了这些结果。
他们不仅发现免疫细胞和成纤维细胞在应答者的HCC样本中更常见,还发现应答者中差异表达最大的基因是免疫相关基因,包括细胞因子CCL19、CXCL14和CXCL6。无应答者的样本主要由癌细胞组成,并大量表达已知的肿瘤标志物,如AFP和IGF2。通过基因集富集分析,他们还发现无应答者的样本不仅缺乏免疫相关基因的表达,还高水平表达了参与代谢和细胞增殖途径的基因。
这些结果表明,无应答者的肿瘤细胞对CABO/NIV治疗的免疫激活作用应答效果不佳,并继续不受控制地扩增和扩散。
约翰霍普金斯大学医学院的研究人员随后通过分析相邻细胞中的表达,确定了相关的细胞间相互作用。癌细胞与肿瘤微环境之间的交互在肿瘤应答和耐药性中起了关键作用。他们预计这种分析将揭示潜在的生物标志物和治疗攻击点。
事实的确如此。他们单独分析了每个患者样本中癌细胞、免疫细胞和癌症相关成纤维细胞之间的相互作用,以此来说明异质性。他们鉴定出空间聚类,并用计算工具Domino来寻找转录活跃的细胞间信号通路(8)。在应答者样本中,他们发现转录因子PAX5(B细胞分化和功能的关键调控因子)上调的基因在与肿瘤细胞区域相邻的免疫细胞区域中高表达。此外,PAX5活性与高表达B细胞标志物的Visium数据点有着共同定位。
此外,癌细胞与癌症相关成纤维细胞相互作用的区域显示出细胞外基质重塑调控途径的活性增加,其特点是胶原蛋白生成基因COL1A1和COL3A1的表达增加。
“这些研究结果表明,启动或维持B细胞活性,再加上CAF抑制剂,也许是提高治疗HCC的免疫疗法效果的替代方法,”作者说。
这项研究深入阐明了应答者与无应答者之间的差异,但仍有一个紧迫的问题:在对CABO/NIVO疗法有应答的五名患者中,为什么有一人在手术后一年出现疾病复发?他们将这名复杂患者的样本与其他四名手术后三年也没有复发的患者进行比较。
疾病复发的应答者的关键差异在于存在癌症干细胞(CSC)的分子特征。CSC会无限增殖,并高度耐受癌症疗法,包括PD-1抑制剂nivolumab等免疫疗法。带有CSC的肿瘤在治疗后往往会复发。他们仔细研究了癌症基因组图谱中具有CSC分子特征的其他HCC样本,发现这些肿瘤被免疫抑制性T细胞高度浸润,而不是免疫激活性B细胞。他们的结果与CSC容易逃避免疫系统并在治疗后持续存在的观念相符。
最后,数据不仅帮助研究人员区分了应答者和无应答者,还帮助他们找到了耐药和复发的标志物。无应答者不包含CSC分子特征。这种划分将有助于研究人员继续调整治疗方法,并实现个性化治疗。
打败癌症的进化
空间转录组学让科学家能够在细胞背景下了解肿瘤应答和耐药性的分子基础。正如上述研究所证明的那样,它对探究细胞间相互作用和细胞间信号传导的作用特别有用,这些在肿瘤与其微环境的互作中起着关键作用。我们很高兴看到空间转录组学如何继续帮助研究人员分析患者样本,鉴定新的生物标志物和药物靶点,并向真正的个性化医疗迈进。
参考文献:
1. Tammela T and Sage J. Investigating tumor heterogeneity in mouse models. Ann Rev of Cancer Biol 4: 99–119 (2020). doi: 10.1146/annurev-cancerbio-030419-033413
2. Yuan Z, et al. Presence of complete murine viral genome sequences in patient-derived xenografts. Nat Commun 12: 2031 (2021). doi: 10.1038/s41467-021-22200-5
3. Gonzalez-Silva L, et al. Tumor functional heterogeneity unraveled by scRNA-seq technologies. Trends in Cancer 6: 13–19 (2020). doi: 10.1016/j.trecan.2021.02.001
4. Lyubetskaya A, et al. Assessment of spatial transcriptomics for oncology discovery. Cell Reports Methods 2: 100340 (2022). doi: 10.1016/j.crmeth.2022.100340
5. Zhang S, et al. Spatial transcriptomics analysis of neoadjuvant cabozantinib and nivolumab in advanced hepatocellular carcinoma identifies independent mechanisms of resistance and recurrence. bioRxiv (2023). doi: 10.1101/2023.01.10.523481
6. Sung H, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin 71: 209–249 (2021). doi: 10.3322/caac.21660
7. Ho WJ, et al. Neoadjuvant cabozantinib and nivolumab convert locally advanced hepatocellular carcinoma into resectable disease with enhanced antitumor immunity. Nat Cancer 2: 891–903 (2021). doi: 10.1038/s43018-021-00234-4
8. Cherry C, et al. Computational reconstruction of the signalling networks surrounding implanted biomaterials from single-cell transcriptomics. Nat Biomed Eng 5: 1228–1238 (2021). doi:10.1038/s41551-021-00770-5