
-

生物通官微
陪你抓住生命科技
跳动的脉搏
MERFISH再发力,揭示系统性红斑狼疮引发的精神障碍!
【字体: 大 中 小 】 时间:2023年05月23日 来源:
编辑推荐:
近期哈佛大学Michael C. Carroll研究团队使用神经精神狼疮(NPSLE)小鼠模型,基于单核测序以及MERFISH技术,确定了神经精神狼疮小鼠大脑中所有主要的细胞类型以及空间分布。成功地发现了神经精神狼疮小鼠神经系统中IFN-I信号的富集区域,并确定了相关的差异基因表达模式和细胞类型。
基础研究的最终目的是为了向临床转化,能更好地解决患者的实际问题。近期哈佛大学Michael C. Carroll研究团队使用神经精神狼疮(NPSLE)小鼠模型,基于单核测序以及MERFISH技术,确定了神经精神狼疮小鼠大脑中所有主要的细胞类型以及空间分布。成功地发现了神经精神狼疮小鼠神经系统中IFN-I信号的富集区域,并确定了相关的差异基因表达模式和细胞类型。进而揭示了神经精神狼疮神经系统损伤的分子机制,为系统性红斑狼疮的治疗提供了新的思路和方法。
MERFISH
MERFISH(Multiplexed error-robust fluorescence in situ hybridization)即多重荧光原位杂交技术,突破了传统的smFISH一次检测3-5种基因的局限,通过组合标记、超高分辨率顺序成像,可同时检测多至500种基因和6种蛋白的表达和空间定位,得出组织全景图片、细胞图片、检测到的所有转录本、显示每个转录本在细胞中的空间分布并对其定量,实现真正意义上的单细胞原位空间转录组研究,是单细胞测序技术不可或缺的验证手段,同时更加擅长检测到低表达丰度的转录本、发现新的细胞亚型、揭示微环境等。MERFISH技术诞生于美国哈佛大学庄小威院士实验室,在空间转录组研究领域是不可或缺的研究手段。
背景介绍
系统性红斑狼疮(SLE)是一种自身免疫性疾病,其表现为多个器官受损,包括皮肤、关节、肾脏、心血管系统和中枢神经系统。在系统性红斑狼疮患者中,神经精神症状非常普遍,高达80%的成年人和95%的儿童患者都能观察到这种症状,包括抑郁、焦虑、认知障碍和精神病等。I型干扰素,特别是干扰素α与系统性红斑狼疮及其相关的神经精神症状的发病机制有关。然而,目前尚不清楚中枢神经系统中的I型干扰素信号如何导致神经精神症状。
2023年4月哈佛大学研究团队发表在bioRxiv上的预印版文章Spatial enrichment of the type 1 interferon signature in the brain of a neuropsychiatric lupus murine model探究了SLE神经精神症状的发病机制,特别是与免疫系统激活相关的发病机制。研究团队采用了一种神经精神狼疮(NPSLE)小鼠模型,使用高分辨率MERFISH技术对小鼠脑组织进行了分析,以探索其分子机制。
一、自身免疫相关因子的外周血含量
首先,研究人员使用NPSLE小鼠模型(Sle1/Yaa),和对照小鼠(B6)外周血,检测了在人类同源基因的多项研究中从狼疮患者的PBMC中表达量高的ISG(干扰素刺激基因)基因的动力学表达水平,分别是Mx1、Ifit3、Oas2、ISG15、Rsad2。结果表明这些基因在大约14周龄时达到峰值(如图1所示)。同时自身抗体滴度试验也印证了这一结果(如图2所示)。这些结果表明,Sle1/Yaa狼疮小鼠模型中关键的外周血自身免疫相关因素在8周龄与对照小鼠开始出现差异,14周龄达到差异高峰。
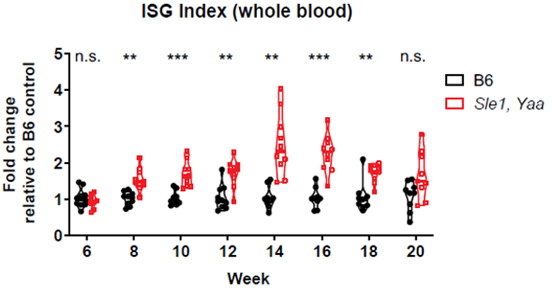
图1. ISG在外周血中的表达量
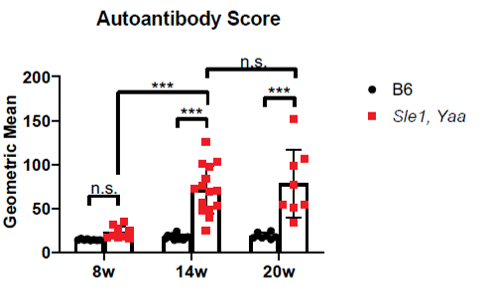
图2. 自身抗体滴度
二、小鼠模型的行为评估
紧接着,研究人员评估了模型小鼠的行为表现。研究人员对14周龄的小鼠进行了行为测试,结果显示Sle1/Yaa小鼠表现出更多的焦虑(图3A-3B)和疲劳(图3C-3F)行为。这些行为学实验的结果进一步支持了 Sle1/Yaa 小鼠存在自身免疫反应和神经精神症状相关表型的结论。
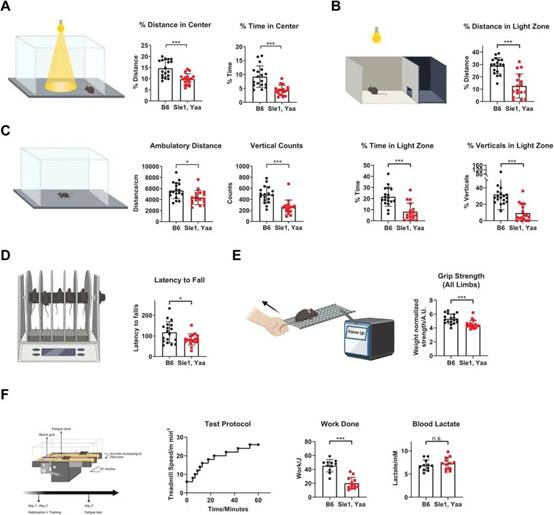
图3. Sle1/Yaa小鼠焦虑和疲劳行为表型。(A)明亮的开放场地测试通过受试者在明亮的场地围栏的中心而不是其外围的探索行为来测量焦虑。Sle1/Yaa小鼠移动,在明亮的中心区域花费的时间更少。(B)明暗盒测试通过受试者在明亮的一半围栏而不是黑暗的覆盖的一半中的探索行为来衡量焦虑。Sle1/Yaa小鼠在明亮的盒子的一半中表现出较少的探索行为。(C)运动测试测量低压力环境中的一般探索行为。与B1对照相比,Sle1/Yaa小鼠表现出较少的运动和垂直探索行为。(D)旋转测试测量一般运动能力。与B6对照相比,Sle1/Yaa小鼠表现出留在加速杆上的能力降低。(E)握力测试测量一般肌肉力量。与B6对照相比,Sle1/Yaa小鼠表现出更多的肌肉无力。(F)跑步机疲劳测试测量运动引起的疲劳阈值。与B6对照相比,Sle1/Yaa小鼠表现出增加的疲劳倾向。运动后的乳酸水平没有显示出任何差异,表明疲劳样表型不太可能由肌肉缺陷驱动,但可能是神经炎症因素。
三、I型干扰素信号显著上调
随后,研究人员选择了ISG富集程度和一致性相对较高的大脑区域即海马区和后脑区进行单核测序。针对Sle1/Yaa狼疮小鼠模型,他们确定了这两个脑区的主要细胞类型(如图4所示),同时发现ISG基因主要在海马区和后脑区的血管以及神经胶质细胞类型中富集(星形胶质细胞和少突胶质细胞构成了ISG表达细胞簇的主体)(如图5所示)。通过基因表达差异分析,在野生型B6和Sle1/Yaa小鼠两个脑区的差异表达基因中,ISG占了大多数。作者发现了多个基因表达上调或下调的信号通路,最显著的变化是I型干扰素信号通路的显著上调(如图6所示)。
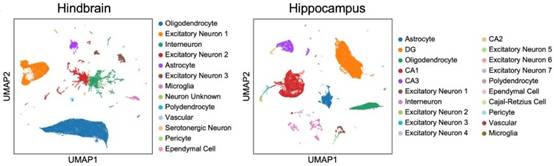
图4. 后脑和海马区内所有主要细胞类别的UMAP图
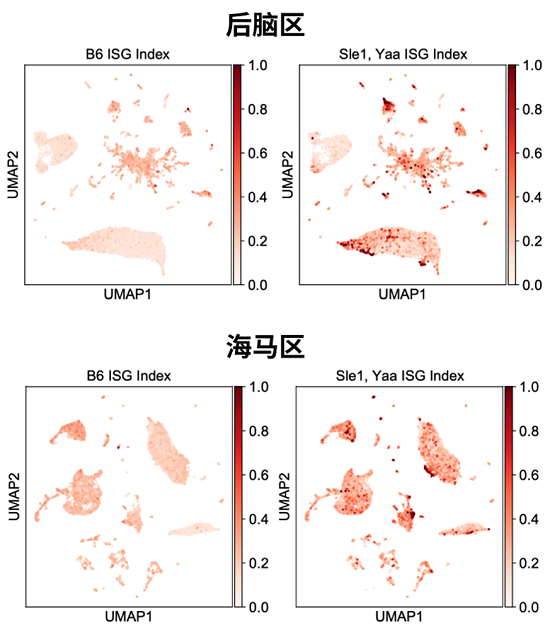
图5. 后脑区和海马区的UMAP图,按基因型分离,由ISG表达指数着色
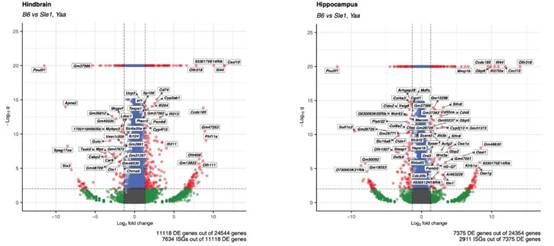
图6. 火山图显示B6和Sle1/Yaa基因型之间后脑和海马体中差异表达的基因
有趣的是,研究人员的分析显示了大脑区域之间生物通路的不对称下调:神经系统发育和神经发生相关通路仅在后脑星形胶质细胞中下调,脂质代谢信号通路仅在海马区星形胶质细胞中下调,这表明星形胶质细胞对IFNα的生物学反应可能存在区域差异。两个脑区的少突胶质细胞普遍下调了神经元发育和突触相互作用途径,表明它们与中枢神经系统细胞类型的相互作用较少,进一步定义导致这些细胞类型减少相互作用的因素将有助于解释Sle1/Yaa小鼠的行为表型。
四、MERFISH助力基因表达分布研究
最后,鉴于大脑各区域的不同功能,研究人员假设 ISG 富集的空间特异性可能是行为差异的基础。利用MERFISH技术,设计了一个224个基因的panel,其中包括58个ISG(选择这些基因是鉴于I型干扰素在调节神经元放电率和增加小胶质细胞突触吞噬方面的已知作用,这两者都会影响行为结果)。研究人员中分析了超过400,000个细胞,转录本约为1.97亿,并确定了符合其预期的大脑中存在的所有主要细胞类别(如图7所示),及其空间分布(如图8所示)。研究人员发现,ISG在空间上被分隔成不同的脑实质斑块(如图9所示),不同ISG具有不同的空间位置(如图10所示)。ISG在脑中呈现斑块化分布,并且横跨脑,表明I型干扰素信号在该疾病模型中的激活状态在空间上表现出高度异质性,可能是由于干扰素I型信号的激活是在某些特定的细胞类型或组织区域发生的,而在其他区域则没有或仅有很低的激活。这些结果表明,中枢神经系统中的I型干扰素可能通过不同区域的激活抑制细胞通讯途径,从而在介导NPSLE行为表型中发挥重要的机制作用。1型干扰素信号调节剂是NPSLE的潜在治疗选择。
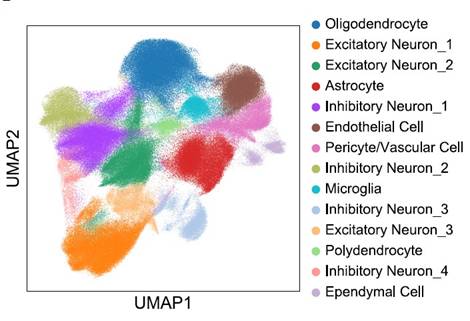
图7. 脑实质内所有主要细胞类别的UMAP图
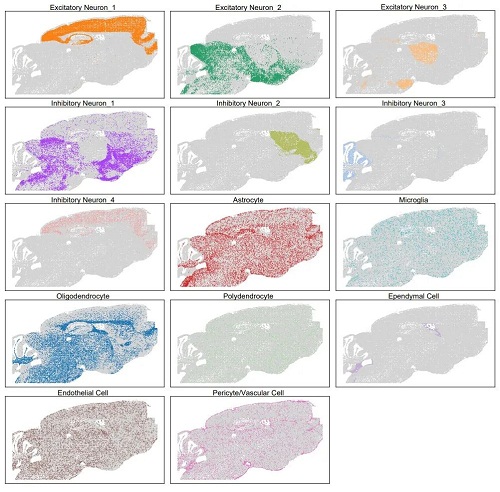
图8. 脑实质中不同类型细胞的空间分布
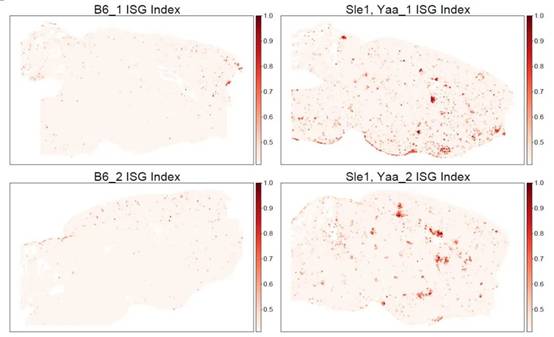
图9. 每个单独样本的ISG分布空间图,显示Sle1/Yaa小鼠中ISG含量高的细胞簇状斑块
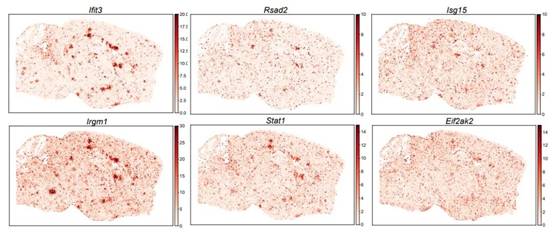
图10. 不同ISG的分布范围
研究人员通过MERFISH技术成功地发现了SLE小鼠神经系统中IFN-I信号的富集区域,并确定了相关的差异基因表达模式和细胞类型。进而揭示了SLE神经系统损伤的分子机制,为SLE的治疗提供了新的思路和方法。这表明MERFISH技术在探索复杂疾病的分子机制方面具有重要的应用价值。
2021年美国Vizgen公司经授权开发并商品化出MERSCOPE™超分辨荧光显微成像分析平台,可以对12cm组织以100nm分辨率单次原位检测几百上千种基因,基于其高灵敏度的检测有助于分析低表达丰度的转录本并借此鉴定分析稀有罕见的细胞类型以及细胞亚型。通过分析细胞之间的空间邻近以分析细胞互作、细胞通讯,揭示组织细胞类型组成以及微环境。

参考文献:
Aw E, Lin S L, Zhang Y, et al. Spatial enrichment of the type 1 interferon signature in the brain of a neuropsychiatric lupus murine model[J]. bioRxiv, 2023: 2023.04. 21.537814.