
-

生物通官微
陪你抓住生命科技
跳动的脉搏
MERFISH助力解析肝癌患者对PD-1治疗有响应的免疫应答机制
【字体: 大 中 小 】 时间:2023年07月11日 来源:
编辑推荐:
该研究在肝细胞癌(HCC)患者中进行了一项大型新辅助PD-1阻断试验,来寻找T细胞浸润的肿瘤中响应免疫检查点阻断(ICB)反应的相关因素。
文献速递
6月15日,西奈山伊坎医学院Dr. Miriam梅拉德实验室在Nature Medicine上发表了题为“Intratumoral dendritic cell - CD4+ T helper cell niches enable CD8+ T cell differentiation following PD-1 blockade in hepatocellular carcinoma”的研究。该研究在肝细胞癌(HCC)患者中进行了一项大型新辅助PD-1阻断试验,来寻找T细胞浸润的肿瘤中响应免疫检查点阻断(ICB)反应的相关因素。研究发现,在接受ICB治疗的患者中,包括mregDC和CXCL13+ Th细胞在内的微环境控制着局部肿瘤特异性CD8 T前体细胞向效应CD8 T细胞的分化。

1 部分T细胞浸润的HCC患者不响应PD-1阻断
研究人员分析了29例早期HCC患者和对应的非受损肝脏样本,发现30%(经Cemiplimab治疗)和22%(经Nivolumab治疗)的患者响应ICB,并且这些肿瘤样本的T细胞浸润的程度和分布具有高度异质性(图1A)。值得注意的是,所有响应PD-1治疗和40%不响应治疗的患者体内发现存在T细胞的高度浸润(图1A-C)。不同的是,在响应PD-1治疗的患者中,肿瘤组织中具有相同T细胞受体(TCR)的T细胞克隆的含量明显高于邻近组织,而在T细胞浸润但不响应PD-1治疗的患者中肿瘤中T细胞克隆的富集程度仅略高于邻近组织(图1G-H)。除此之外,响应PD-1治疗的患者中CD4 T细胞和CD8 T细胞也显著增加,而在T细胞浸润的非响应PD-1治疗的患者中Tregs细胞更丰富(图1I)。
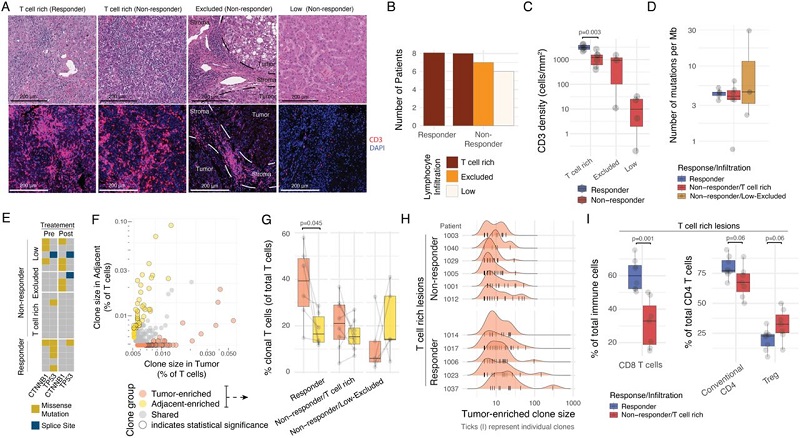
图1. 部分T浸润细胞的肿瘤不响应PD-1阻断。
2 鉴定响应PD-1治疗的HCC患者中肿瘤浸润性CD8和CD4 T细胞的不同分子表型
研究表明,响应PD-1治疗的患者中PD-1hi效应样CD8 T细胞和CXCL13+ Th细胞均显著富集(图2G-H),而且优先克隆扩增,这表明CXCL13+ Th可能与PD-1hi CD8 T细胞协同在抗肿瘤免疫中发挥作用(图2I-J)。而PD-1hi终末分化的CD8 T细胞和Tregs细胞则在无响应PD-1治疗的患者的肿瘤中优先克隆扩增(图2I-J)。
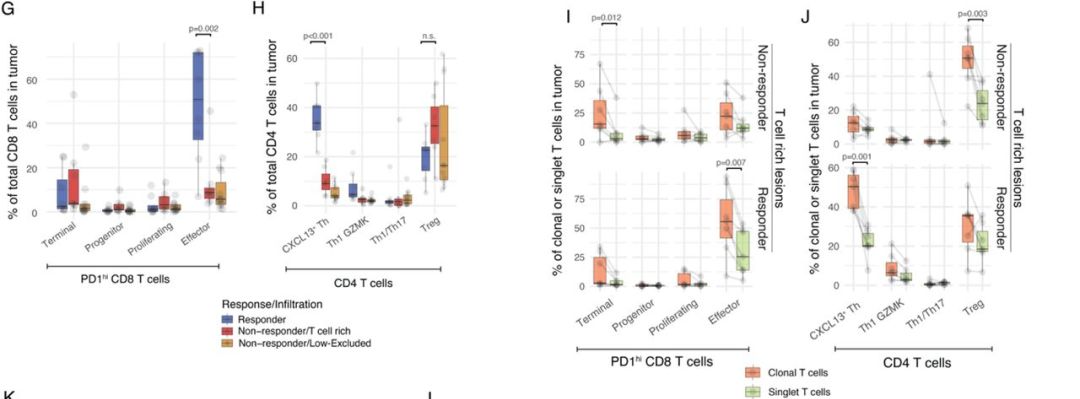
图2. 响应PD-1治疗的患者具有CD8和CD4 T细胞以肿瘤特异性方式克隆扩增的独特分子表型
3 PD-1阻断后,CD8和CD4 T细胞在局部肿瘤微环境中局部扩增和分化
研究人员进一步研究不同CD8 T细胞转录状态之间的关系,发现无论响不响应PD-1治疗,T细胞浸润型患者的肿瘤组织中都存在CD8 T细胞的局部分化和扩增:在响应PD-1治疗的患者中,CD8 T细胞分化明显倾向于PD-1hi效应样细胞,而在无响应PD-1治疗的患者中倾向于分化为PD-1hi终末分化的CD8 T细胞(图3A-3B)。此外,CXCL13+ Th也与PD-1hi CD8 T细胞簇一样,在PD-1阻断后也会发生大量扩增(图3C)。
通过TCR成像和TCR-seq分析治疗前后的肿瘤样本,发现PD-1阻断下扩增的肿瘤T细胞克隆在治疗前就存在于肿瘤中(图3D),而且在大多数患者中,与CXCL13+ Th和PD-1hi效应CD8 T细胞相关的大多数TCR β克隆也在治疗前就存在于肿瘤中(图3E)。
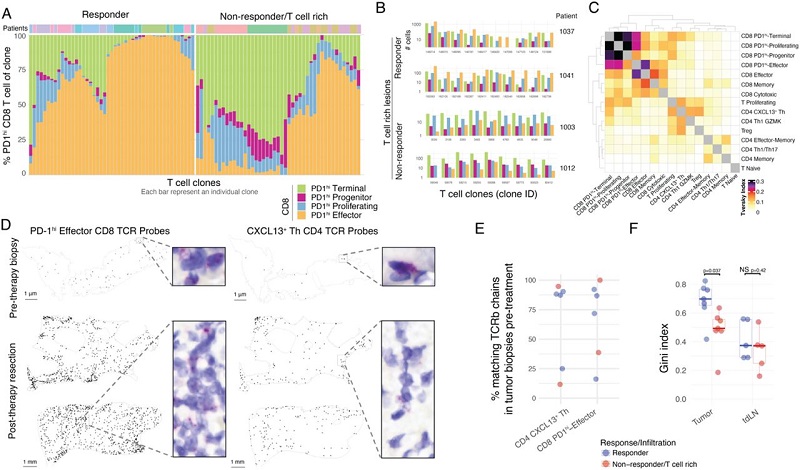
图3.PD-4阻断后肿瘤中CD8和CD1 T细胞的局部扩增。
4 鉴定局部肿瘤微环境中与PD-1hi CD8 T细胞再激活相关的免疫细胞hub
由于T细胞分化为效应细胞需要DC细胞,DC细胞除了提供TCR外,还提供驱动T细胞效应功能的细胞因子和共刺激信号,因此研究人员假设特定的DC程序可能负责协调效应PD-1hi CD8 T细胞的扩增。于是分析了3种DC细胞——cDC1、cDC2 和“mregDC”,发现mregDC表达最高水平的共刺激和抑制分子(CD80/CD86, PD-L1和PD-L2)和最高水平的MHC-II,表明mregDC在治疗初期的人类非小细胞肺癌中优先与CD4 T细胞结合,这可能是在响应PD-1治疗的患者中观察到的CXCL13+ Th和PD-1hi效应样CD8 T细胞局部扩张的基础(图4-1)。
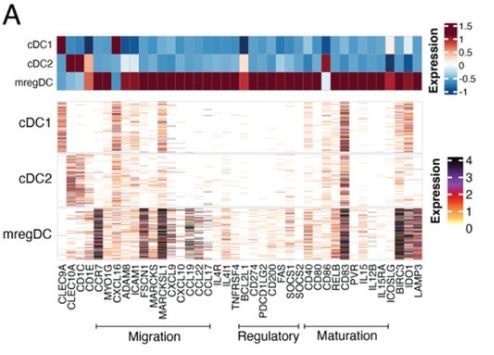
图4-1. mregDC、CD8 T前体细胞和CXCL13 Th细胞组成的免疫细胞hub与PD-1阻断反应相关。
那么为什么肿瘤克隆会在响应PD-1治疗的患者中局部扩增和分化呢?
研究人员给出了答案:基于MERFISH技术,研究人员设计了一个包含405个基因的panel对一张响应PD-1治疗患者的完整肿瘤切片的461,533个细胞进行了高度多重的RNA原位检测(图4-2)。
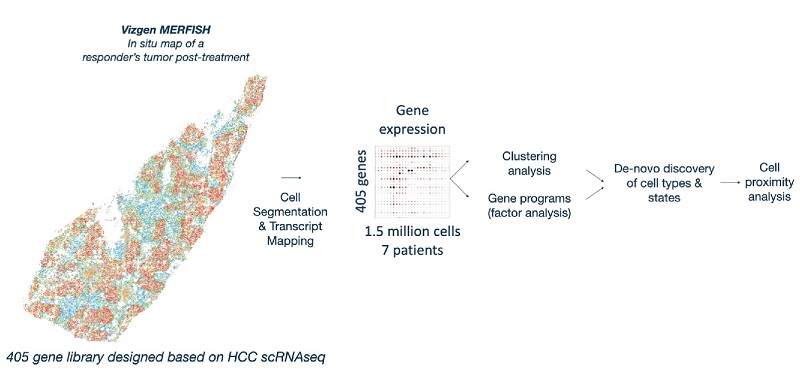
图4-2. MERFISH实验设计。
基于空间临近分析,发现响应PD-1治疗的患者肿瘤组织中CD8 T前体细胞、CXCL13+ Th细胞和mregDC在有B细胞离散分布的生态位中共定位(图4-3)。紧邻B细胞分布着CD8 T前体细胞和CXCL13+ Th细胞,最外围分布着成熟的DC细胞,这三者相互聚集形成免疫hub,可能对促进PD-1hi CD8 T前体细胞局部分化为效应样CD8 T细胞至关重要,并且对于HCC中PD-1阻断治疗的成功至关重要(图5)。
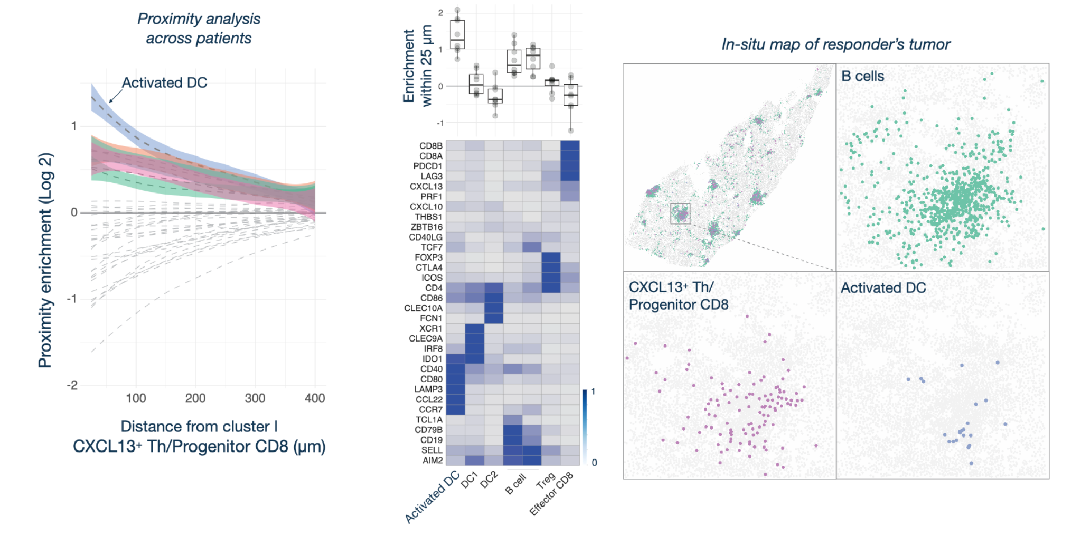
图4-3. mregDC、CD8 T前体细胞和CXCL13 Th细胞组成的免疫细胞hub与PD-1阻断反应相关。
5 讨论
基于组学数据,研究人员发现存在响应PD-1治疗的患者中,ICB应答与肿瘤内CXCL13+ Th和 PD-1hi效应样CD8 T细胞的克隆扩增相关,而在无响应PD-1治疗的患者中,PD-1hi 终末分化CD8 T细胞占主导地位。且大多数治疗后扩增的TCR克隆在治疗前就存在于肿瘤中。
但由于缺少空间证据来还原具体的作用机制,于是研究人员采用了MERFISH技术利用空间层面上的信息补全了该机制:证明了在PD-1阻断后,mregDC有可能促进CXCL13 Th细胞的活化,从而增强抗体的产生并有助于肿瘤清除和Fc介导的肿瘤抗原呈递增强,以促进CD8 T前体细胞在PD-1阻断下存活和分化为有效的抗肿瘤CD1 T细胞。
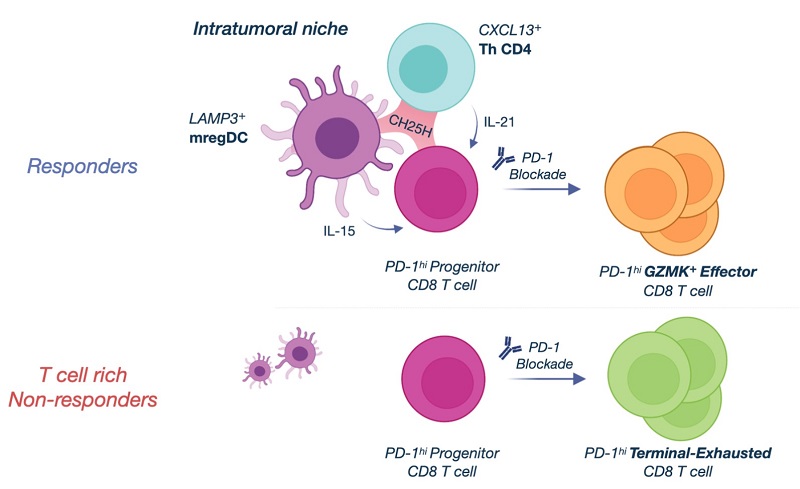
图5. mregDC、CD8 T前体细胞和CXCL13 Th细胞组成的免疫细胞hub的机制图。
MERSCOPE超分辨荧光显微成像分析平台
本文中研究者使用商品化的MERSCOPE平台开展了MERFISH实验。
2021年美国Vizgen公司经授权开发并商品化出MERSCOPE™超分辨荧光显微成像分析平台,可以对12cm组织以100nm分辨率单次原位检测几百上千种基因,基于其高灵敏度的检测有助于分析低表达丰度的转录本并借此鉴定分析稀有罕见的细胞类型以及细胞亚型。通过分析细胞之间的空间邻近以分析细胞互作、细胞通讯,揭示组织细胞类型组成以及微环境。
