
-

生物通官微
陪你抓住生命科技
跳动的脉搏
HiFi长读长测序揭示癌细胞增殖及死亡的分子机制
【字体: 大 中 小 】 时间:2023年09月12日 来源:基因有限公司
编辑推荐:
在研究过程中,团队多次借助HiFi测序对转录组进行分析,正是由于其既长(长达25kb)且准(Q30)的特点能帮助全面表征转录组,直接获得全长转录本以对选择性剪接、选择性多聚腺苷酸化、转录本异构体等进行研究,助力具体分子机制的解析。
Background
传统上,RNA被分为编码RNA和非编码RNA,编码RNA被翻译成蛋白质。然而,最近的研究发现,存在同时具有编码和非编码功能的双功能RNA。为了建立一个准确的方法来确定RNA的双重性质,来自日本的团队开发了一个新的索引,称为ORF优势度评分,其定义为最长ORF占转录序列中所有假定ORF长度总和的分数,该分数与编码转录物和非编码RNA的翻译效率相关(图1)。

图1.ORF优势度的定义
他们利用ORF优势度对癌症转录本进行了研究。癌细胞表达独特的RNA转录物,在癌症的发生和发展中发挥作用,通过RNA测序了解转录组的重要性持续增长。短读测序(short-read sequencing,SR-seq)通过读取较短的片段(最多约150 bp),并将reads映射到参考序列来重建原始序列,可以检测到大约20%-40%的总转录本。相比之下,长读测序(long-read sequencing, LR-seq)可以一次检测数万个碱基对,允许对全长转录本直接测序,有助于鉴定各种癌症类型的新型癌症特异性异构体。因此,研究团队结合基于HiFi测序所得的LR-seq数据和ORF优势度进行转录组分析,并为癌症进化提供新的见解。
1. LR-seq数据揭示癌变过程中ORF优势度变化
为了深入了解在癌变过程中ORF优势度变化的意义,研究人员计算了从正常组织和癌组织中获得的转录组的ORF优势度,并比较了它们的分布。作者首先使用全基因组泛癌症分析(PCAWG)项目获得的SR-seq数据,比较了所有癌症特异性转录本(Cancer-specific most dominant transcripts,cMDTs)和正常组织转录本(normal tissue transcripts,nMDTs)的ORF优势度分布。与nMDTs相比,cMDTs的ORF优势度明显增加(图2A)。接着,研究人员重点研究了cMDTs中致癌基因和肿瘤抑制基因的转录本,并将它们与nMDTs进行了比较。发现仅在致癌基因中,cMDTs的ORF优势性显著增加(图2B)。在癌变过程中,ORF转录物的优势度总体呈上升趋势,特别是致癌基因和癌症类型特异性转录物的ORF优势度升高。对nMDT和cMDT之间ORF优势度变化超过0.1的基因集进行GO分析发现,ORF显性的变化可能与癌变过程中涉及的生理功能有关,如细胞器、细胞周期和DNA损伤反应。
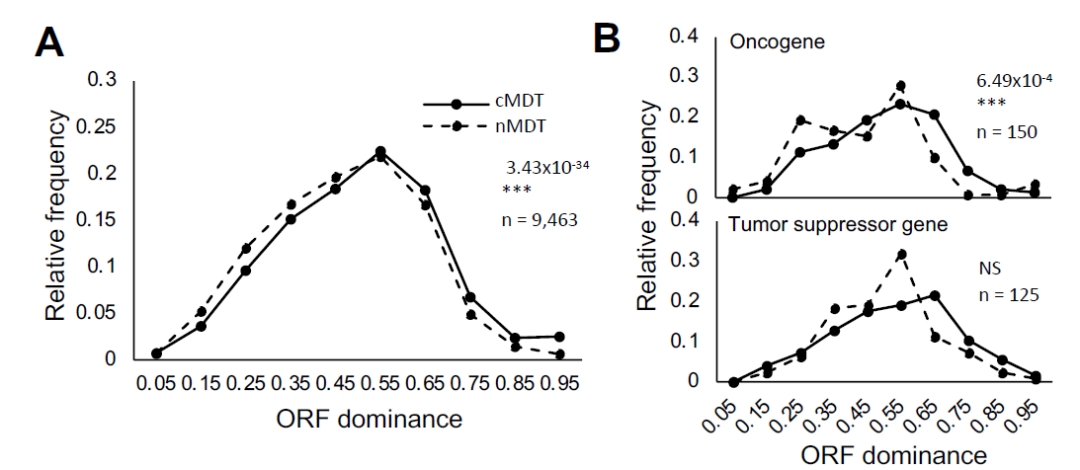
图2.cMDTs和nMDTs的ORF优势分布
基于上述SR-seq数据在肺腺癌和肝细胞癌中未观察到ORF优势度变化。然而,最近利用LR-seq的研究已经在这些癌症类型的样本和细胞系中发现了癌症特异性异构体。因此,研究人员使用这些新数据集重新评估了ORF优势度,并观察到在许多肺腺癌样本和细胞系中,ORF优势度向更高的值显著转变(图3)。在肺腺癌细胞系数据中,所有携带KRAS突变的细胞系都表现出ORF优势度的显著变化,而那些携带NRAS或EGFR突变的细胞系则没有表现出显著变化(图3A)。相反,在肝细胞癌中,观察到ORF优势度向较低值显著转变(图3B)。这些结果表明,LR-seq在检测ORF优势度变化方面具有很高的敏感性。
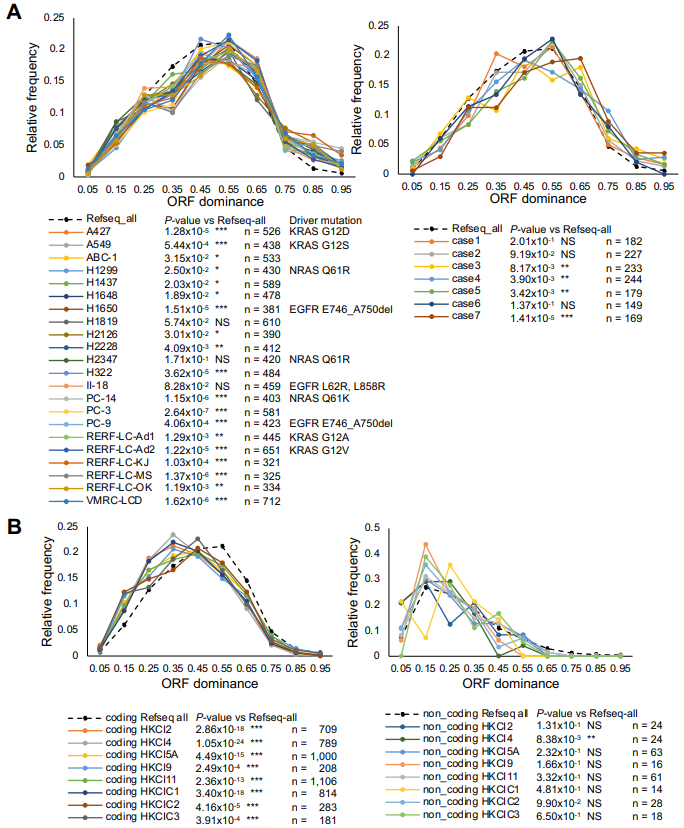
图3.基于LR-seq的肺癌和肝癌ORF优势度分布
除此之外,作者还利用多种小鼠癌变模型的LR-seq数据研究了在癌变和癌症进展过程中ORF优势度变化。研究阐明了ORF优势度在癌症进化过程中的变化意义:(1)ORF优势度在癌变过程中发生广泛的变化,影响翻译效率,导致与细胞增殖相关的癌基因表达增加,而与DNA损伤反应相关的基因表达减少。(2)致癌过程中ORF优势度的变化主要不是由基因突变驱动的,而是由表观遗传和/或转录改变等其他机制驱动的。(3)在转移性肿瘤发生前,编码RNA和非编码RNA的界限变得模糊。
然而,受ORF优势度变化影响的基因是否真的在致癌和癌症进展中起作用?作者又进行了更为深入系统的分析。
2. 抑制OCT4在MYCN位点的结合可诱导神经母细胞瘤细胞死亡
神经母细胞瘤(Neuroblastoma, NB)是儿童中最常见的颅外实体瘤,占儿童癌症相关死亡的12%-15%(1-3)。至少40%的NB被指定为高风险肿瘤,在25%的高风险病例中观察到MYCN扩增,并且与NB患者的不良临床结果相关。
包括OCT4、MYCN、CTCF和p53在内的多种转录因子通过与MYCN位点结合来调节MYCN的表达。研究人员探讨了这些转录因子在NB细胞存活中的作用。在MYCN扩增的NB细胞系中,使用CRISPR/deactivated Cas9 (dCas9)技术特异性抑制转录因子与MYCN位点的结合。转染dCas9 24小时后,CRISPR/dCas9抑制OCT4 在MYCN位点的结合(图4A, B),与对照组(不含sgRNA的dCas9)相比,抑制了MYCN mRNA的表达(图4C)。Western blotting显示,在dCas9转染72 h后,MYCN蛋白的表达减少291(图4D)。因此,抑制OCT4在MYCN位点(人类特异性OCT4 - MYCN正反馈回路的关键位点)的结合,可降低MYCN活性并进一步诱导NB细胞死亡。

图4.通过dCas9技术特异性抑制OCT4在MYCN位点的结合可降低MYCN活性
使用长读RNA-seq数据对细胞死亡分子机制的详细研究表明,抑制MYCN活性后下调的转录本与高ORF优势度得分相关,而ORF优势度得分与转录本的翻译效率相关。这些转录本富含剪接因子,包括MYCN靶基因HNRNPA1和PTBP1。HNRNPA1和PTBP1调节丙酮酸激酶基因(PKM)的选择性剪接,并促进从典型异构体PKM1到癌症相关异构体PKM2的转换。这些剪接因子的表达降低改变了PKM mRNA剪接,同时诱导p53 - caspase-2 - MDM2介导的细胞死亡。这些发现表明,破坏人类特异性的OCT4-MYCN正反馈回路可能是治疗MYCN扩增NB的一种有希望的策略。
参考文献:
https://doi.org/10.15252/embr.202154321
https://doi.org/10.1101/2023.06.02.543339
https://doi.org/10.1101/2023.06.08.544289
Summary
该团队基于ORF优势度做了系统性研究,挖掘癌变过程中ORF优势度变化的意义,探究受ORF优势度影响的基因在癌症进展中的作用,为癌症的治疗提供一种可行策略。
在研究过程中,团队多次借助HiFi测序对转录组进行分析,正是由于其既长(长达25kb)且准(Q30)的特点能帮助全面表征转录组,直接获得全长转录本以对选择性剪接、选择性多聚腺苷酸化、转录本异构体等进行研究,助力具体分子机制的解析。
基于HiFi测序的全长转录本测序技术Iso-seq可以直接测得RNA的全长转录本,无需组装即可表征转录组的完整多样性,准确鉴定转录本异构体。相比于传统的短读长RNA-Seq,Iso-Seq具有以下优势:
发现可变起始位点和终止位点,检测可变多聚腺苷化
揭示复杂可变剪接、融合事件以及转录通读
鉴定等位基因特异性异构体
此外,PacBio现已推出针对单细胞全长转录组测序的建库试剂盒MAS-seq,将短的10x Genomics cDNA串联建库,连接起来再进行HiFi测序,从而解决长读长单细胞RNA测序的通量瓶颈,将有效数据产量扩大16倍。并且后续PacBio计划将串联测序技术扩展到Bulk RNA测序和16S rRNA等关键应用,也将在转录组测序、16S测序等方面为客户提供更加具有成本效益的成套解决方案,大家敬请期待~
基因有限公司作为PacBio公司中国区代理商,自2011年以来将PacBio第三代单分子实时测序技术引入国内,一直为国内用户提供专业的三代测序系统的安装培训,技术支持,应用培训与售后维护工作,赢得客户的一致好评与信任。基因有限公司将一如既往的支持越来越多的PacBio用户。
