
-

生物通官微
陪你抓住生命科技
跳动的脉搏
Nature Neuroscience:MERFISH揭示阿尔茨海默症进展的细胞图谱变化
【字体: 大 中 小 】 时间:2024年12月17日 来源:基因有限公司
编辑推荐:
本研究利用多组学、空间转录组学(MERFISH单细胞原位空间转录组技术)以及来自BRAIN Initiative的参考图谱,对84名不同AD病理阶段捐赠者的大脑颞中回(MTG)细胞类型进行了综合分析,揭示疾病进展对MTG细胞类型的影响。
阿尔茨海默病(AD)是一种神经退行性疾病,是老年人痴呆的最常见原因,其病理特征主要包括β-淀粉样蛋白(Aβ)形成的淀粉样斑块和过度磷酸化Tau蛋白形成的神经纤维缠结。神经病理学和影像学研究表明,蛋白质聚集体呈渐进性和稳定性积累,但到目前为止,驱动AD进展和受疾病影响的脆弱细胞群的潜在分子和细胞机制仍然知之甚少。因此,本研究利用多组学、空间转录组学(MERFISH单细胞原位空间转录组技术)以及来自BRAIN Initiative的参考图谱,对84名不同AD病理阶段捐赠者的大脑颞中回(MTG)细胞类型进行了综合分析,揭示疾病进展对MTG细胞类型的影响。该研究“Integrated multimodal cell atlas of Alzheimer’s disease”于今年10月14日由美国艾伦脑科学研究所Ed S.Lein研究团队发表在国际著名期刊《Nature Neuroscience》上。

本研究使用基于图像的定量神经病理学方法,将涵盖阿尔茨海默病不同疾病阶段的84名供者进行连续的疾病假性进展分析和多组学技术分析,结果发现,在AD的早期阶段,病理变化缓慢,存在炎症小胶质细胞、反应性星形胶质细胞、生长抑素(Somatostatin+)抑制神经元的丢失以及少突胶质细胞前体细胞的髓鞘再生反应;在晚期阶段,病理变化呈指数级增长,兴奋性神经元和Pvalb+和Vip+抑制性神经元亚型丢失。
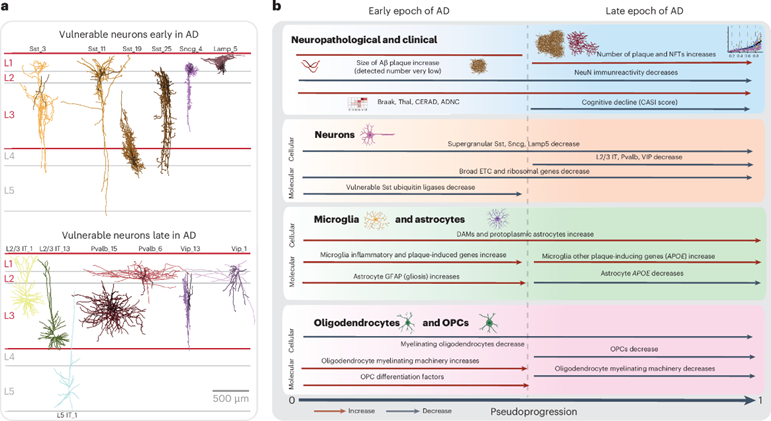
MTG受AD影响的细胞主要定位在表层,可分为早期和晚期阶段
研究结果
01 不同病理阶段的AD进展及严重程度分析
为构建AD和相关痴呆症的综合多模态细胞图谱,本研究通过定量神经病理学、单核RNA-Seq、单核ATAC-Seq、单核多组学和单细胞分辨率的空间转录组学(MERFISH)技术,对阿尔茨海默病不同疾病进展的84名患者样本进行分析,共分析了340万个高质量细胞核,并将它们分类到139种分子细胞类型。另外,基于定量神经病理学构建了连续的伪进展评分(CPS),用于追踪AD疾病进展,为AD的病理严重程度提供了一个连续的量化指标。结果发现,严重受影响的供体经历了全局性染色质抑制,导致转录关闭;疾病进展存在两个明显不同的阶段,早期阶段以神经元丢失和早期淀粉样病理为特征,晚期阶段则以病理水平显著增加和认知障碍为主。这些发现为理解AD的病理过程以及为未来的研究和治疗提供了重要的数据资源和理论支撑。
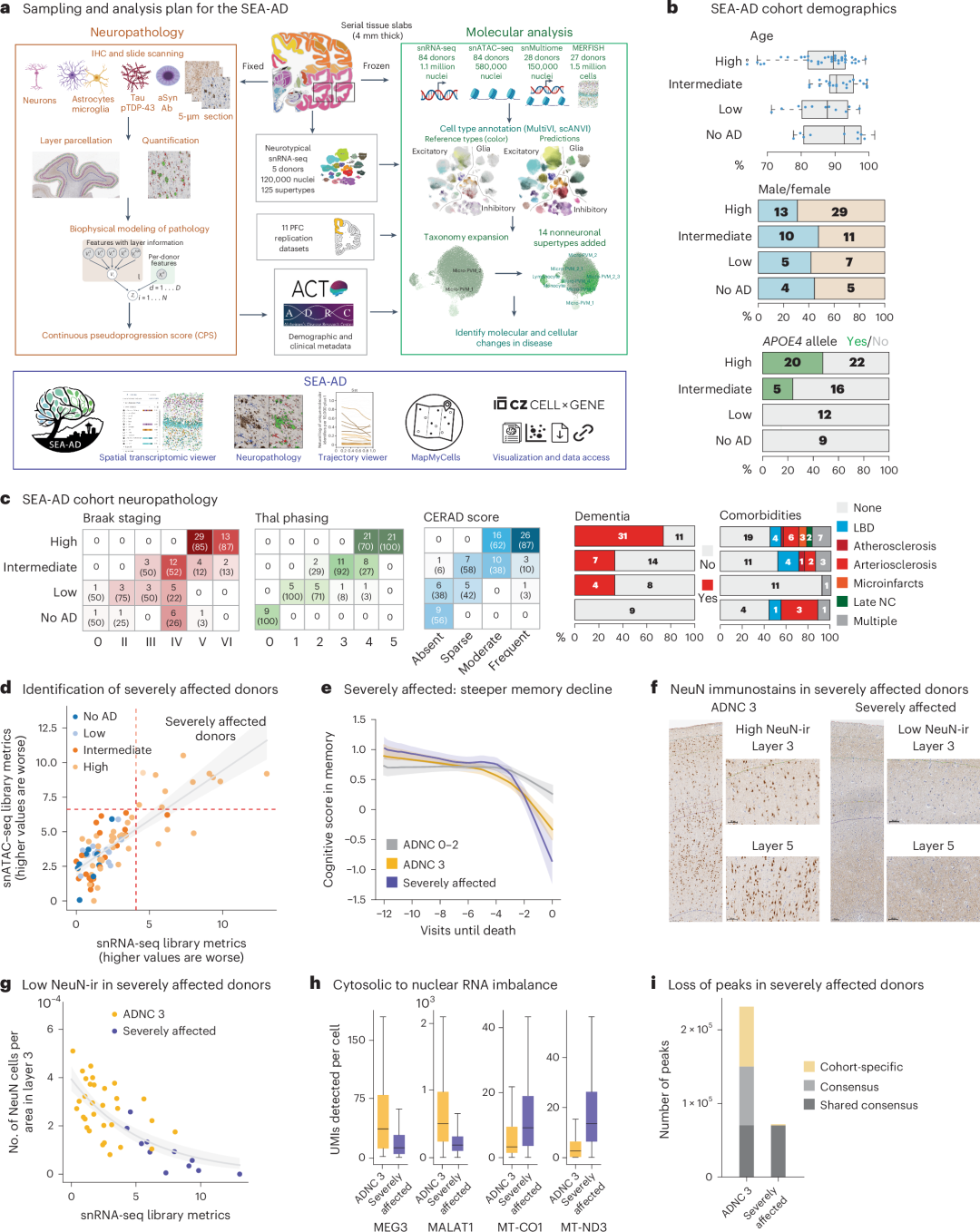
图1. MTG和SEA-AD研究设计和队列描述。a,实验设计示意图;b,SEA-AD人口统计数据;c,SEA-AD 队列神经病理学特征;d,数据质量评估;e,认知功能趋势分析;f-g,神经元变化特征分析;h-i,分子和染色质特征分析。
02 在MTG中构建集成的多模态AD图谱并表征易感和疾病相关超型
为将SEA-AD数据一致地映射到所有84个供体的细胞类型,本研究参考BICCN数据建立了一个包含139种supertype(超型)的SEA-AD细胞分类体系,这些超型代表了可以在整个数据集中一致映射的细胞类型。并使用相同的映射方法分析 SEA-AD单核RNA-seq和单核多组学数据,发现了一些SEA-AD特有的非神经元细胞类型或状态,并将其纳入最终的分类体系。研究发现,在AD进展过程中,特定神经元和非神经元超型的相对丰度会发生变化,其中多种易受影响的神经元超型的丰度随着疾病严重程度的增加而减少,而少数特定的非神经元超型相对丰度上升,这些变化反映了疾病的易感性和相关性,为理解AD中细胞层面的变化提供了重要信息。

图2. 易感群体集中在MTG的浅层。a,使用分层机器学习将SEA-AD核映射至Brain Initiative细胞分类,定义神经元超型;b,超型相对丰度变化表征;c,超型丰度动态变化;d,MERFISH和snRNA-seq中易感Sst超型丰度的相关性验证。
为了定义超型的空间分布并验证细胞变化,本研究使用140个基因panel进行MERFISH分析,创建了一个大规模、细胞解析的MERFISH数据集,并包括来自SEA-AD供体子集的 69个切片。该数据集通过了严格的质量控制指标,如图3所示,与来自脑样本的Bulk RNA-seq和整个组织切片的转录本计数相比,该数据集表现出高度的技术可重复性和超型定位准确性。在将空间转录组数据集中的每个细胞映射到亚类和超型后发现,预期空间分布和映射空间分布之间存在一致性,供体匹配的单核RNA-Seq和MERFISH数据之间也表现出高度一致的基因表达模式。
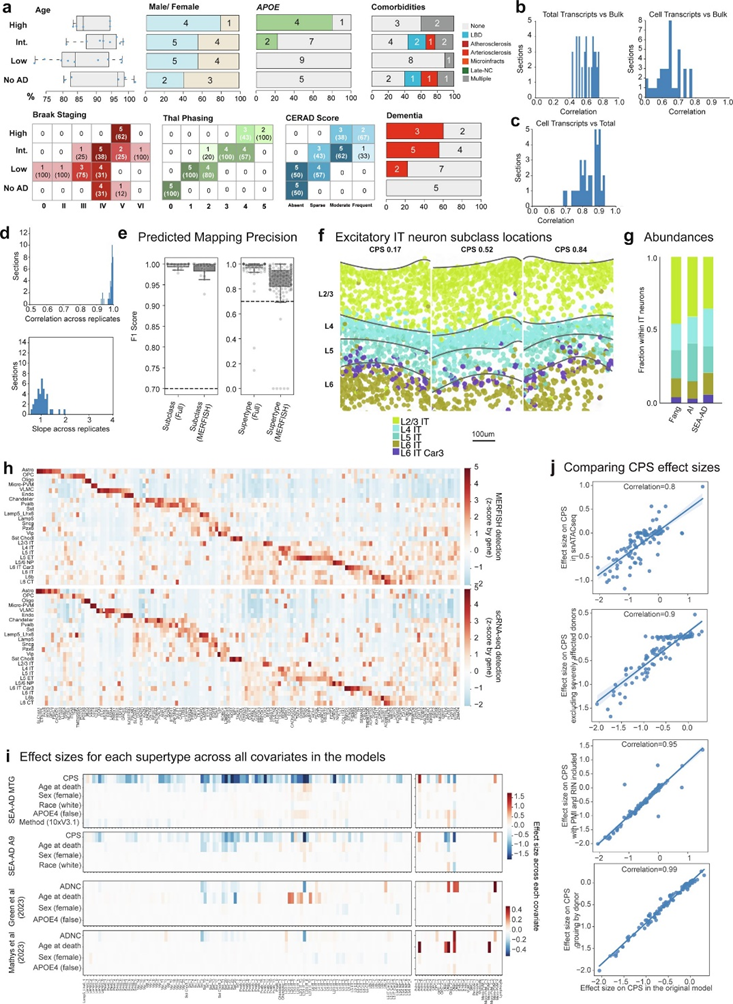
图3. 获取高质量人类MTG空间转录数据的pipeline。
03 社区AD数据的综合图谱
以往的研究描述了与AD相关的分子和细胞变化,但若没有常见的细胞类型注释,交叉研究对比是具有挑战性的。为证实该研究结果,本研究通过整合和协调来自十个额外的AD研究的前额皮质(PFC)的单核RNA-Seq数据和相关供体元数据(涵盖707名供体),构建了一个社区AD数据的综合图谱。这些数据集涵盖了不同程度斑块和缠结病理的供体,其中SEA-AD队列包含了更多具有神经纤维缠结扩散到PFC(Braak阶段V和VI)的供体。通过将所有数据集映射到BRAIN Initiative A9细胞分类法,研究人员能够跨所有细胞和每个细胞类型邻域构建一个综合表示法,这为比较不同研究结果提供了共同的细胞注释基础。
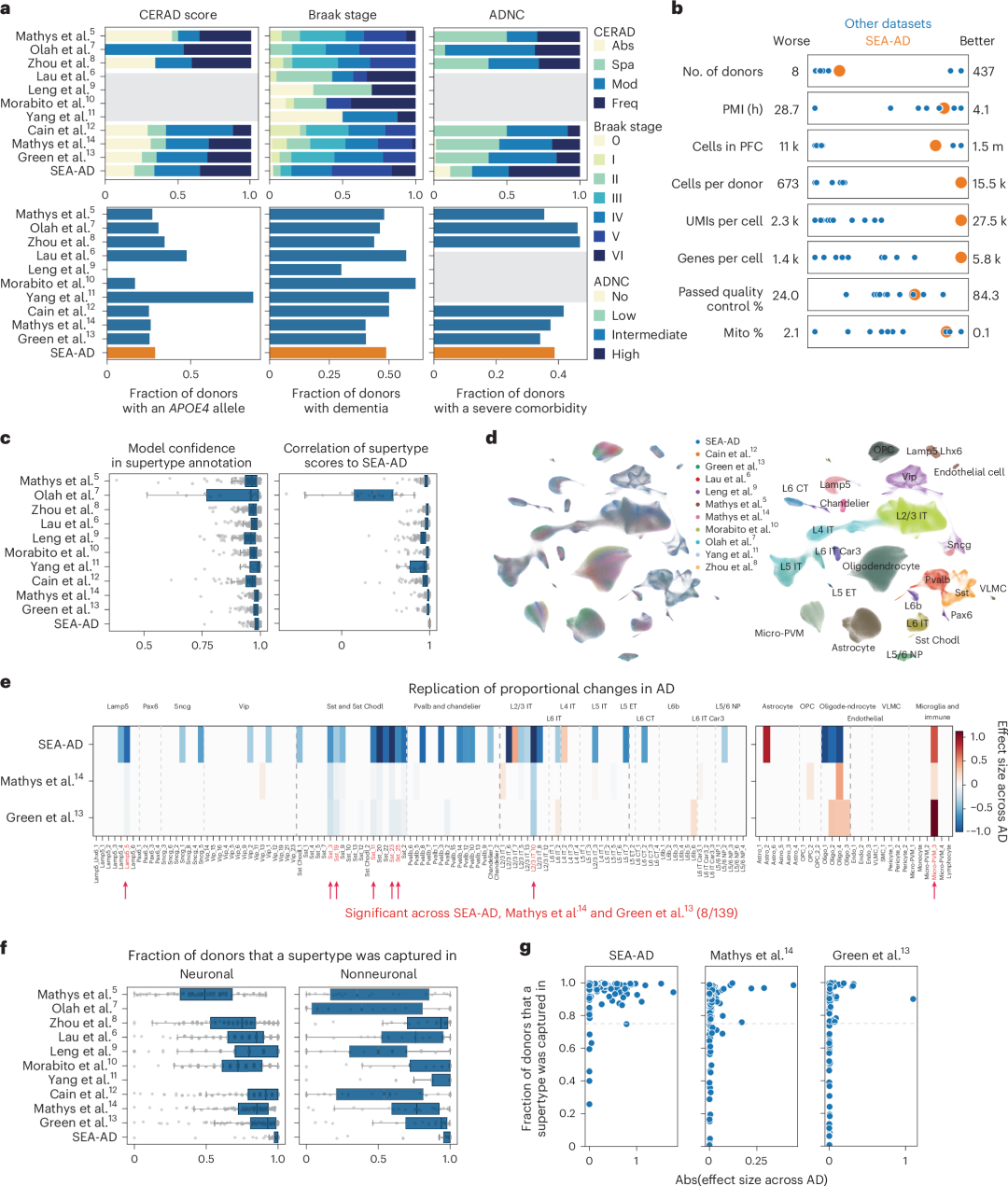
图4. A9单核数据整合验证MTG的易感群体。a,各个公开的单核RNA-Seq数据集比较;b,公开数据集与SEA-AD数据集的质量比较;c,跨数据集标注和特征的一致性;d,不同数据集来源和细胞类型的UMAP图;e,热图比较SEA-AD和其他研究中的A9超型相对丰度变化;f,不同研究中每个超型被捕获的供体比例;g,超型效应值与供体捕获比例的关系。
04 AD早期易受攻击的Sst神经元
在AD早期,几乎所有易受影响的Sst神经元亚型主要位于上层(supragranular)皮层,MERFISH原位单细胞空间转录组分析显示,来自内侧神经节隆起(MGE)衍生的易受影响的Sst和Pvalb亚型也主要定位于这些上层皮层,主要是第二和第三层。此外,易受影响的Sst亚型与Pvalb亚型在转录上相似,类似于同一亚类中未受影响的亚型。在AD中,易受影响的Sst亚型显示出特定的分子变化,与其他所有神经元亚型不同,它们不会下调电子传递链(ETC)和核糖体基因的组成部分。与未受影响的Sst亚型相比,易受影响的Sst亚型共同下调了特异性激酶和E3泛素连接酶。在CPS早期,包括神经生长因子(NGF)和全基因组关联研究中的膜金属内肽酶(MME)在内的一些基因被显著下调,这可能影响与易受影响Sst亚型的通讯,进而影响髓鞘形成。
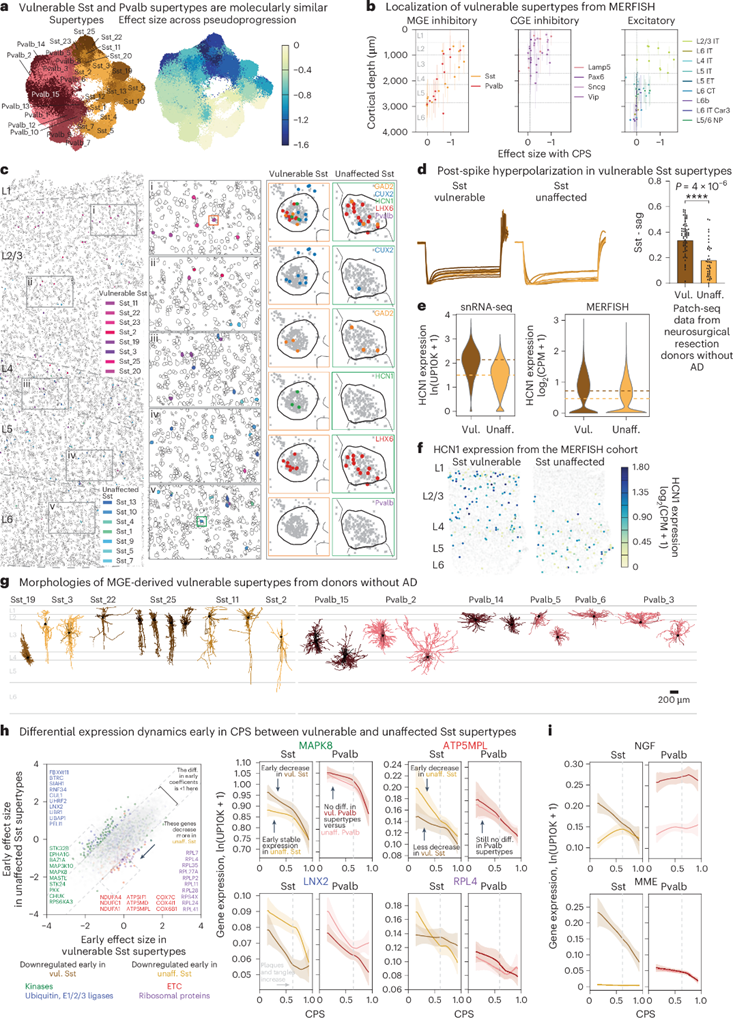
图5. 表层易感MGE来源的抑制性中间神经元的变化与共同电生理特征。a,分子相似的MGE来源抑制性神经元的UMAP图;b,基于MERFISH分析易受影响的超型丰度变化效应值与皮层深度的关系;c,MERFISH分析识别浅层中易感Sst神经元的丢失;d,Sst神经元尖峰后电位过度极化轨迹和Sag分布;e-f,HCN1在易感Sst超型中高表达的小提琴图和散点图;g-h,非AD供体中间神经元的形态重建和基因表达变化;i,基因表达随CPS的动态变化。
05 AD早期的小胶质细胞和星形胶质细胞活化
通过单核RNA-Seq对AD患者大脑中的髓系免疫细胞进行深入分析,发现了与疾病进展相关的小胶质细胞和星形胶质细胞的特定亚型,并揭示了它们在AD早期的分子变化。研究结果表明,AD早期小胶质细胞中促炎症基因和与Aβ斑块相关的基因表达上调,星形胶质细胞则表现出细胞黏附分子和神经元导向信号的上调,而在CPS后期,星形胶质细胞继续上调参与细胞粘附、轴突导向和信号受体的分子。这些分子变化表明在疾病早期所存在的高度刺激的细胞外环境,为AD的病理机制研究提供了新的见解。
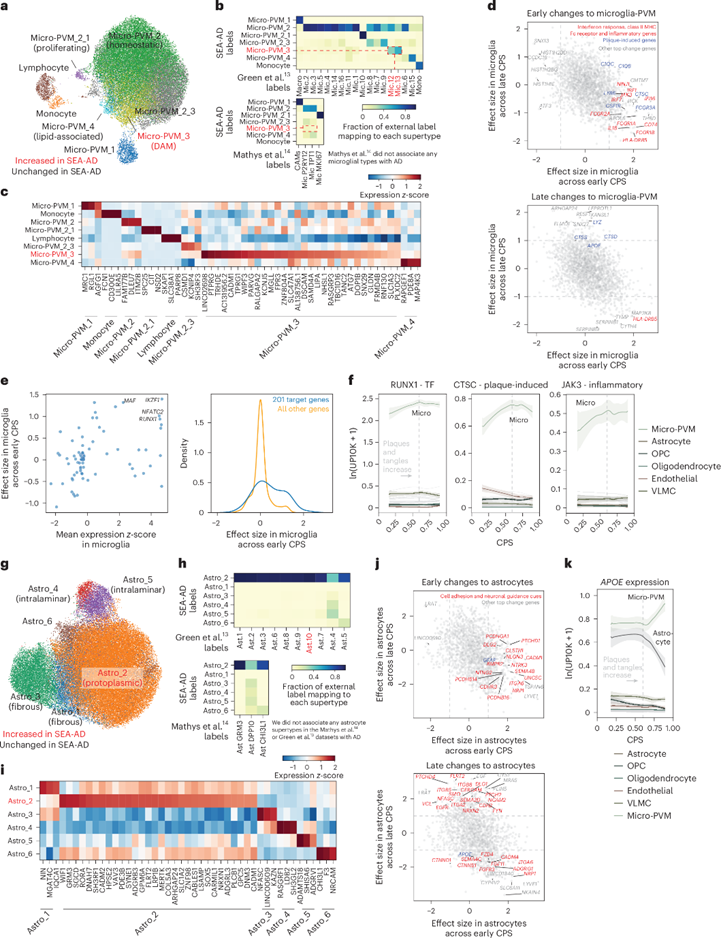
图6. 早期小胶质细胞和星形胶质细胞活化与公开数据集进行比较。a-b,UMAP和热图展示疾病相关小胶质细胞状态及其在不同数据集间的一致性;c,热图显示标记基因在小胶质细胞超型中的表达模式;d-e,散点图和累积分布图比较基因在早期和晚期CPS中的效应值;f,非神经元细胞中的特定基因表达模式;g-h,UMAP和热图比较星形胶质细胞状态;i-k,热图和散点图展示星形胶质细胞基因表达变化以及APOE基因在不同阶段的表达模式。
06 OPC引起的少突胶质细胞丢失和髓鞘再生
在AD早期,两种少突胶质细胞超型(Oligo_2和Oligo_4)易感性增加,可能与细胞毒性水平较高的Aβ分子有关。随着病情进展,少突胶质细胞的髓鞘形成相关基因表达下调,而OPCs中促进分化的转录因子和信号通路激活。这些变化揭示了AD中髓鞘损伤和修复的复杂动态,并可能影响神经元功能和疾病进展。此外,研究发现胰岛素样生长因子(IGF)和血小板衍生生长因子(PDGF)信号通路在OPC分化为少突胶质细胞过程中起重要作用,其中IGF1在晚期表达降低,表明抑制性神经元群体可能是IGF1的主要来源和髓鞘形成的驱动因素。这些发现揭示了AD中少突胶质细胞和OPCs的动态变化,以及它们在疾病过程中可能发挥的作用。
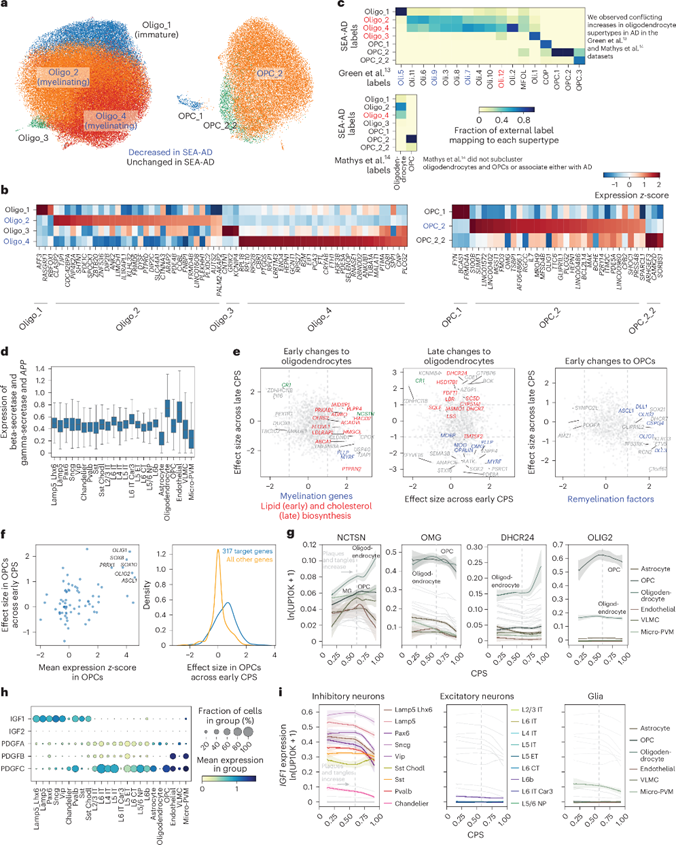
图7. 少突胶质细胞和OPCs在公开数据集中早期丢失和再髓鞘化程序。a,UMAP展示MTG的少突胶质细胞和OPC超型;b,热图显示少突胶质细胞和OPC中标记基因的表达模式;c,跨数据集的超型变化一致性比较;d,箱线图显示β和γ-分泌酶组分以及APP基因在不同细胞亚类中的表达分布;e,散点图比较少突胶质细胞和OPC中基因的效应值变化;f,散点图和累积分布图分析转录因子的调控作用及相应基因的效应值;g-i,LOESS回归图和点图展示特定基因在不同细胞亚类中的表达模式和动态。
MERFISH价值
#1
构建单细胞分辨率的空间多模态细胞图谱:基于MERFISH技术定义AD不同细胞类型在疾病进展阶段的空间分布,以及AD进展过程中细胞类型比例的时空变化分析,从而构建人类大脑中AD的综合高分辨率多模式细胞图谱;
#2
鉴定AD中易感和疾病相关的细胞超型:基于MERFISH技术分析特定细胞超型的空间分布,以特定细胞超型的比例变化为特征,作为疾病严重程度的函数。
2021年,Vizgen率先将整合了MERFISH与超分辨率成像技术的MERSCOPE®分析系统推向市场。基于核心技术MERFISH技术,MERSCOPE®可对最多3cm²的组织进行超分辨成像,分辨率100nm,定位单细胞中RNA的空间分布以及定量基因表达。实现真正意义上的原位单细胞空间转录组分析,让基因的表达和定位可视化,推动基因组学的研究步入下一代。
基因有限公司于2022年3月正式签约成为美国Vizgen公司MERSCOPE®超分辨显微成像分析系统在中国区的合作伙伴。负责该仪器的售前技术咨询、售后安装培训、应用支持等工作。同时,上海贝晶生物技术有限公司也提供MERFISH技术服务。
加微信了解更多!

参考文献:
Gabitto, M.I., Travaglini, K.J., Rachleff, V.M. et al. Integrated multimodal cell atlas of Alzheimer’s disease. Nat Neurosci 27, 2366–2383 (2024). https://doi.org/10.1038/s41593-024-01774-5