
-

生物通官微
陪你抓住生命科技
跳动的脉搏
广州健康院揭示自噬调控人粒系祖细胞扩增的新机制
【字体: 大 中 小 】 时间:2024年03月20日 来源:中国科学院广州生物医药与健康研究院
编辑推荐:
近日,中国科学院广州生物医药与健康研究院潘光锦 团队在S tem Cell Reports 期刊发表了题为“Autophagy is essential for human myelopoiesis”的文章
近日,中国科学院广州生物医药与健康研究院潘光锦团队在Stem Cell Reports期刊发表了题为“Autophagy is essential for human myelopoiesis”的文章。该研究揭示了ATG7依赖的自噬调控人粒系祖细胞在紧急粒细胞分化过程中扩增的作用机制。
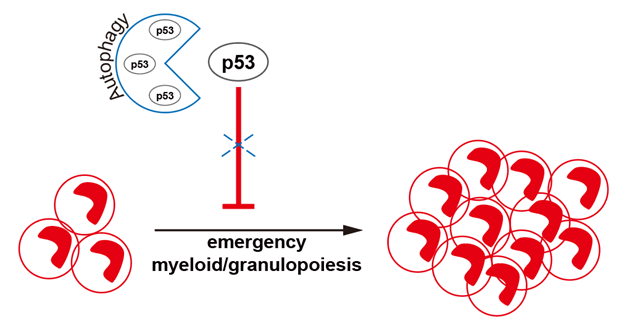
粒细胞是人体内一类重要的免疫细胞,在感染免疫、炎症调控及肿瘤发生等方面均发挥重要作用。当面对系统性感染时,人体启动紧急粒细胞分化(Emergency myelopoiesis,EM)程序,粒系祖细胞(myeloid progenitors,MPs)迅速扩增,产生大量粒细胞抵抗病原体,保护人体健康。然而,在EM过程中,调控MPs扩增的具体机制尚知之甚少。研究报道,自噬在小鼠粒细胞发育过程中扮演着重要角色,而由于伦理和取材的限制,自噬对人粒细胞分化扩增调控的研究相对较少。因此,研究团队基于前期开发的人多能干细胞(human pluripotent stem cells,hPSCs)体外造血分化体系,在体外建立了EM模型,并进行了深入探究。
研究团队在人动员外周血来源的造血干/祖细胞(hematopoietic stem/progenitor cells,HSPCs)及hPSCs来源的HSPCs中,分别对自噬关键基因ATG7进行了敲降或敲除,随后利用体外EM模型进行了探究。研究表明,自噬缺陷的MPs在EM过程中伴随显著的扩增障碍,而只有过表达可回补自噬功能的全长型ATG7,而非突变型ATG7,才可恢复ATG7-/--HSPCs来源MPs在EM过程中的扩增能力。这些结果说明ATG7通过其自噬依赖的功能维持MPs在EM过程中的扩增能力。
接下来,研究团队发现自噬缺陷的MPs中堆积了大量的p53蛋白,而p53的mRNA却没有显著上调,提示自噬可能通过调控p53蛋白的稳定性来发挥重要作用。随后,研究团队利用Co-IP技术,在MPs中检测到了p53蛋白与自噬底物衔接蛋白LC3B的互作,表明p53可作为自噬的降解底物。进一步的结果显示,自噬缺陷显著降低了MPs中p53蛋白和自噬下游重要细胞器-溶酶体的共定位,说明自噬的缺陷导致被运送至溶酶体中进行降解的p53蛋白变少了,进一步验证了p53蛋白被自噬-溶酶体途径降解的机制。而且,在自噬缺陷的MPs中敲降p53后,可显著恢复MPs在EM过程中的扩增能力。
综上,该研究表明了ATG7依赖的自噬通过降解p53蛋白,释放MPs的增殖能力,从而保障了MPs在EM过程中的扩增。该研究为理解人粒细胞的分化扩增调控提供了新的见解,并为临床开发治疗粒细胞白血病的方法提供了潜在靶点。
广州健康院博士后谷佳明、副研究员朱艳玲为该论文的共同第一作者。广州健康院潘光锦研究员为该论文的通讯作者。该研究成果得到了国家重点研发计划、国家自然科学基金等项目的资助。
自噬调控人粒系祖细胞中p53降解的示意图