
-

生物通官微
陪你抓住生命科技
跳动的脉搏
广州健康院揭示BCL11B与NuRD复合物共同调控T细胞命运的新机制
【字体: 大 中 小 】 时间:2024年03月20日 来源:中国科学院广州生物医药与健康研究院
编辑推荐:
9月22日,中国科学院广州生物医药与健康研究院李鹏团队和刘兴国团队共同在国际学术期刊EMBO Journa l 上发表了题为“BCL11B and the NuRD complex cooperatively guard T-cell fate and inhibit OPA1-mediated mitochondrial fusion in T cells”的研究成果,揭示了人成熟T细胞中BCL11B可与NuRD复合物相互作用直接抑制NK细胞相关基因转录,还可间接通过代谢-表观遗传轴维持T细胞命运
9月22日,中国科学院广州生物医药与健康研究院李鹏团队和刘兴国团队共同在国际学术期刊EMBO Journal上发表了题为“BCL11B and the NuRD complex cooperatively guard T-cell fate and inhibit OPA1-mediated mitochondrial fusion in T cells”的研究成果,揭示了人成熟T细胞中BCL11B可与NuRD复合物相互作用直接抑制NK细胞相关基因转录,还可间接通过代谢-表观遗传轴维持T细胞命运。
过继性细胞免疫疗法已成为放化疗之后的又一种有效控制肿瘤的手段。近年来,嵌合抗原受体(Chimeric Antigen Receptor, CAR)T细胞作为过继性细胞疗法的代表,对血液肿瘤表现出强劲的抗肿瘤效果,但在实体瘤的治疗上仍不尽人意。优化、改造免疫细胞是提高实体瘤的免疫治疗的新策略。李鹏团队前期研究发现,通过CRISPR/Cas9系统敲除人成熟T细胞中BCL11B可诱导其重编程为类NK细胞(induced T-to-natural killer cells,ITNK细胞)。ITNK细胞同时具有T细胞和NK细胞的表型和功能特征。在体内外具有更广谱和更强效的抗实体瘤活性。初步临床实验(NCT:03882840)结果也表明,患者自体诱导的 ITNK 细胞对复发难治的晚期实体瘤有一定疗效且不会引起任何严重不良反应。因此 ITNK 细胞可作为一种新的细胞来源用于肿瘤免疫治疗,但其强效抗肿瘤活性的分子机制仍不清楚。
本项研究发现BCL11B可直接与NuRD复合物关键亚基相互作用,抑制T细胞中NK相关基因的表达。敲除NuRD复合物关键亚基,包括MBD2、MTA2和CHD4均可将人成熟T细胞重编程为ITNK细胞,这些ITNK细胞与敲除BCL11B来源的ITNK细胞具有相似的转录本和抗肿瘤活性,为获得ITNK细胞提供了新的来源。
细胞代谢可影响T细胞的分化状态和功能。本研究发现,在T细胞中BCL11B可直接结合在线粒体内膜融合蛋白视神经萎缩1(optic atrophy1,OPA1)基因的TSS区并抑制其转录,敲除BCL11B可上调表达OPA1并介导线粒体融合。融合线粒体促进了ITNK细胞氧化磷酸化(OXPHOS)代谢水平,进而促进ITNK细胞重编程效率和抗肿瘤活性。代谢产物不仅可以作为代谢信号调控细胞生物大分子合成为细胞提供物质和能量,还可作为非代谢信号,通过组蛋白或DNA表观修饰调控基因表达。本研究进一步发现ITNK细胞OXPHOS代谢增强乙酰-CoA水平,高浓度的乙酰-CoA作为组蛋白乙酰化的底物,通过增加NK相关基因及细胞毒性相关基因位点的H3K27乙酰化修饰,促进相关基因的表达,提升ITNK细胞的抗肿瘤活性。
本项研究揭示了转录因子BCL11B在T细胞代谢中的重要作用,丰富了 BCL11B在T细胞中的生物学意义。同时,通过解析ITNK细胞的代谢-表观遗传轴,揭示了代谢重塑通过组蛋白表观修饰调控ITNK细胞抗肿瘤活性的分子机制,为进一步提升ITNK细胞临床治疗实体瘤效果提供了新策略。
中国科学院广州生物医药与健康研究院博士后廖芮、副研究员邬毅为该论文的共同第一作者。中国科学院广州生物医药与健康研究院李鹏研究员、刘兴国研究员为本论文的共同通讯作者。该研究成果得到国家重点研发计划、国家自然科学基金等项目的资助。
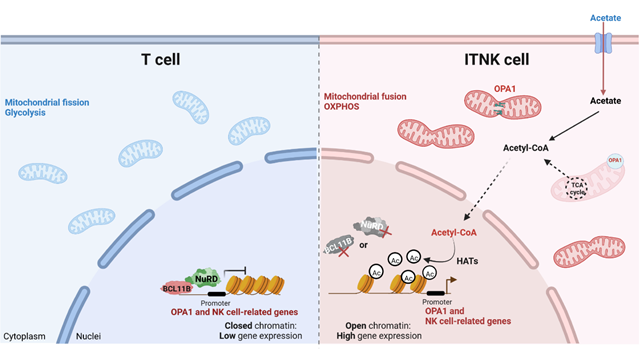
BCL11B与NuRD复合物共同调控T细胞命运的机制研究示意图