
-

生物通官微
陪你抓住生命科技
跳动的脉搏
基于相变设计的双特异性融合蛋白用于条件性肿瘤杀伤
【字体: 大 中 小 】 时间:2024年04月03日 来源:清华园生命学院
编辑推荐:
作为一条新的细胞内关键组织原则,生物大分子相分离在各种生物过程和蛋白聚集疾病的发病机制中发挥着重要作用,因此也成为了生命科学领域的前沿热点之一。各国科学家开始以“相分离/相变”作为全新视角重新审视以往悬而未决的生物学问题。在疾病领域,早期的基础研究主要集中在神经退行性疾病以及肿瘤细胞的异常增殖和免疫逃逸。同时,传统上被认为是“不可靶向”的药物靶点,如转录因子,生物分子凝聚体的发现为开发靶向药物提...
作为一条新的细胞内关键组织原则,生物大分子相分离在各种生物过程和蛋白聚集疾病的发病机制中发挥着重要作用,因此也成为了生命科学领域的前沿热点之一。各国科学家开始以“相分离/相变”作为全新视角重新审视以往悬而未决的生物学问题。
在疾病领域,早期的基础研究主要集中在神经退行性疾病以及肿瘤细胞的异常增殖和免疫逃逸。同时,传统上被认为是“不可靶向”的药物靶点,如转录因子,生物分子凝聚体的发现为开发靶向药物提供了新方向。除了发现新靶点的需求外,开发基于生物分子凝聚体的平台技术也显示出巨大的潜力。
2024年3月28日,清华大学生命科学学院李丕龙课题组在《中国科学生命科学》(Science China Life Science)杂志在线发表了题为“一种相分离强化的双特异性适配体用于条件性肿瘤杀伤”(A phase separation-fortified bi-specific adaptor for conditional tumor killing)的研究论文,开创性地设计了基于相分离元件的治疗性融合蛋白,实现了特异性肿瘤靶向杀伤,为相分离转化应用迈出了重要一步。
在本研究中,研究团队聚焦于调控细胞膜表面受体,实现多维信号的整合与传递。随着研究重点从单一蛋白质功能转向多受体信号复合体的分析,一些关键报告突显了配体寡聚化的优势。然而,传统方法在获取具有精确距离控制和拓扑结构的多价配体方面存在挑战。基于这些重要发现,团队提出核心假设:具有相分离模式的多价配体能够作为解析复杂多受体网络的有效工具。通过采用合成多价治疗配体的策略,可以精细调控信号传导。利用液-液相分离(LLPS)的新兴概念及其在组织并富集细胞表面受体进入功能性区室方面的潜力,团队设计了具有相分离模式的模块化配体,以工程化方式编程受体间通信并精确控制信号通路,从而诱导肿瘤细胞的快速、强效和特异性凋亡。
这类名为“相分离肿瘤杀手(phase-separated Tumor Killer,psTK)”的触发器,尽管设计简约,却能够诱导死亡受体与肿瘤相关受体的共聚集,从而实现相分离介导的条件性凋亡激活(图1)。值得注意的是,传统设计常采用如SUMO3和SIM(SUMO3-interacting motif)这对相互作用基序,通过调整其串联表达的数量来重构多价依赖的相分离现象,但这对后续的产业化应用和转化提出了更高的要求和挑战。为了进一步优化融合蛋白的表达形式,该研究巧妙地设计了基于低价态串联重复的相分离元件,即均为二价PRM和SH3的组合(简称P2S2)。将分别靶向结合肿瘤细胞表面高表达的CXCR4(C-X-C chemokine receptor type 4)和死亡受体DR5(Death receptor 5)的纳米抗体CNB和DNB与P2S2融合表达,得到了融合蛋白CN-P2S2-DN。相比早期设计,CN-P2S2-DN同样能够介导相分离依赖的肿瘤细胞凋亡,且以单一蛋白形式的制备更为高效、便捷。此外,这种设计在肿瘤特异性靶点(包括EGFR、MET等)及疾病适应症的拓展方面也显示出了显著的特异性肿瘤细胞杀伤效果。
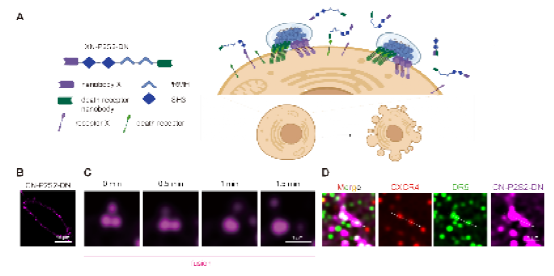
图1 psTK设计示意图及相分离介导的膜受体共聚集
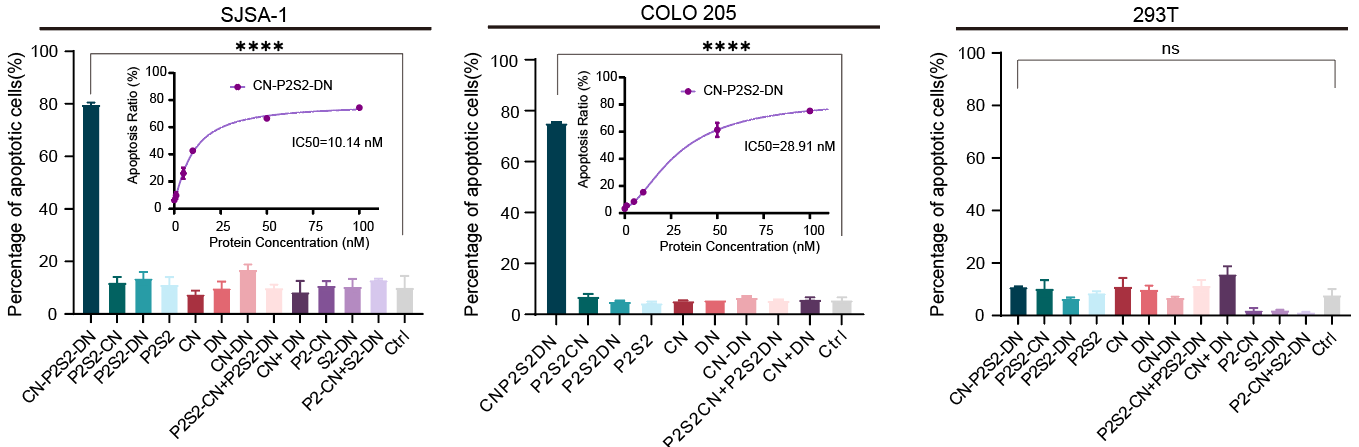
图2 psTK介导的肿瘤特异性杀伤
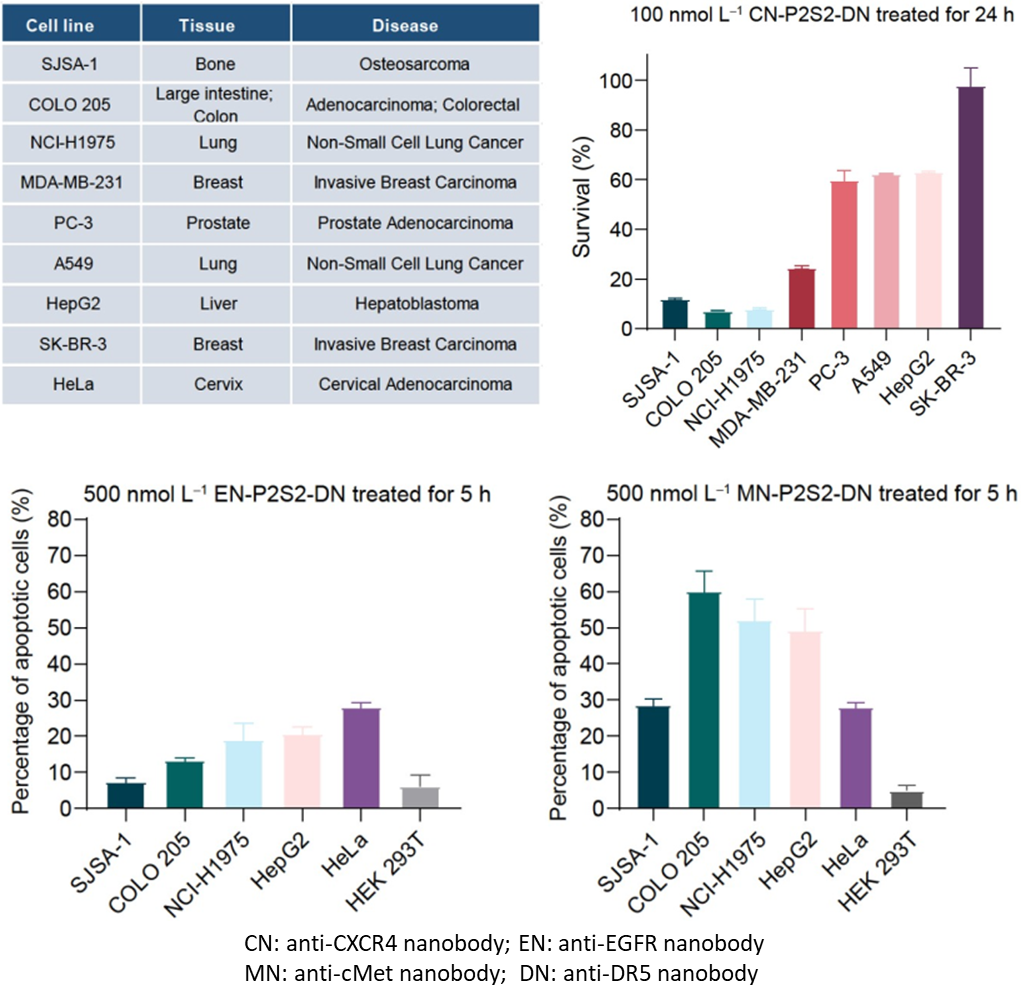
图3 psTK的肿瘤靶点及疾病适应症拓展数据结果
此外,该设计聚焦于肿瘤坏死因子受体超家族成员,优选死亡受体家族成员。作为重要的疾病治疗靶点,其被激活后可以诱导癌细胞死亡。当前,缺乏有效的免疫细胞浸润是实体瘤免疫治疗的一个重要障碍。通过激活实体瘤中富集的死亡受体,例如DR5,可以实现肿瘤细胞的减灭,这被视为一个有前景的治疗策略。在过去的几十年里,许多DR5激动剂抗体在进入实体瘤临床试验后均未能成功,无法显著提高患者生存率。这促使研究人员致力于开发第二代DR5激动剂,以在肿瘤中实现高度特异性的细胞凋亡毒性。根据前期临床试验中DR5激动剂的经验教训,该论文的创新设计在实现条件性激活DR5的同时,也提高了DR5激动剂的稳定性和生物活性,通过调整相分离元件的价态,有望识别不同表达丰度的肿瘤表面特异性抗原,且现有数据展示出了只触发肿瘤细胞凋亡而不影响健康细胞的良好安全性。
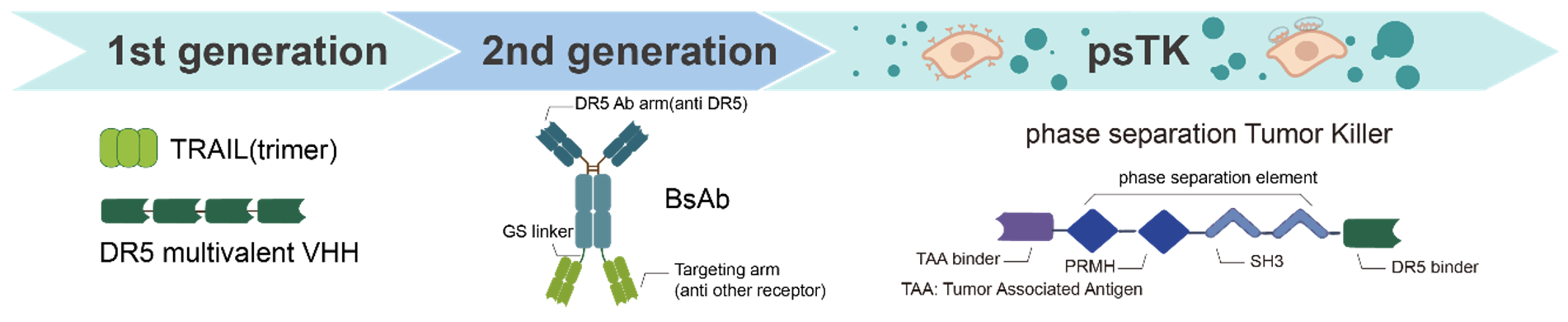
图4 基于相分离设计的新一代DR5激动剂开发迭代示意图
综上所述,该研究首创了一类基于相分离的细胞膜蛋白调控系统,具有可操纵性强、灵活度高、普适性好等诸多优势,有望成为基于膜受体治疗的新范式,并期待实现生物药的创新突破。
清华大学生命科学学院、膜生物学国家重点实验室、北京生物结构前沿研究中心、清华-北大生命科学联合中心李丕龙副教授与生命科学学院已出站博士后许伟凡博士为本文共同通讯作者;清华大学生命科学学院2020级博士生刘雨嫣、2019级博士生朱雨婷为本文的共同第一作者。本研究得到了国家自然科学基金专项项目的经费支持。
原文链接:http://engine.scichina.com/doi/10.1007/s11427-023-2490-2