
-

生物通官微
陪你抓住生命科技
跳动的脉搏
单细胞测序分析阐明一种联合疗法招募的干细胞群有利于癌症患者的自体干细胞移植
【字体: 大 中 小 】 时间:2024年04月22日 来源:10x Genomics
编辑推荐:
在这篇文章中,我们将讨论研究人员如何对一项国际多中心III期临床试验中的患者样本进行单细胞RNA测序(scRNA-seq)分析,鉴定出推动自体干细胞移植(ASCT)取得成功的造血干/祖细胞群(HSPC)。
成功的临床试验有多种形式。一些临床试验发现了变革性的治疗方法,而另一些虽然未达到主要终点,但也能产生重要的生物学见解,指导未来的药物发现工作。在“值得关注的临床试验”系列文章中,我们将重点介绍单细胞多组学和空间基因表达在各个试验阶段的临床样本中的创新应用。
欢迎关注这一系列文章,了解我们的工具如何帮助研究人员分析整个试验过程中采集的患者样本,并揭示可预测治疗应答的稀有细胞群、可改善患者分层的生物标志物或新的作用机制。
在这篇文章中,我们将讨论研究人员如何对一项国际多中心III期临床试验中的患者样本进行单细胞RNA测序(scRNA-seq)分析,鉴定出推动自体干细胞移植(ASCT)取得成功的造血干/祖细胞群(HSPC)。这项III期临床试验测试了一种新的联合疗法是否能提高多发性骨髓瘤(MM)患者的HSPC动员的效果。
这项试验的结果于2023年4月发表在《Nature》杂志上。结果表明,BioLineRx公司的候选药物motixafortide与粒细胞集落刺激因子(G-CSF)filgrastim(HSPC动员的标准药物)联合使用,能够更有效地动员干细胞用于MM患者的ASCT(1)。
美国FDA于去年9月批准了这种联合疗法。BioLineRx公司在获批后的新闻稿中提到,APHEXDA(motixafortide)是“美国十年来首个在多发性骨髓瘤的干细胞动员方面获批的创新药物”(2)。
但创新并没有随着FDA的批准而结束。对此次试验期间采集的患者样本进行scRNA-seq分析,首次提供了一些生物学线索,说明HSPC的哪些群体最有利于长期ASCT成功。
III期:一种多肽抑制剂可改善HSPC向血液的动员
癌症类型:多发性骨髓瘤
疗法:APHEXDA(motixafortide)与filgrastim(G-CSF)联用
试验目标:与安慰剂 + filgrastim相比,评估APHEXDA与filgrastim联用在动员HSPC用于多发性骨髓瘤患者ASCT上的安全性和有效性
领导机构:圣路易斯华盛顿大学医学院和加州大学洛杉矶分校医学院
合作制药机构:BioLineRx
ClinicalTrials.gov注册编号:NCT03246529
✔ 为什么HSPC动员对多发性骨髓瘤患者的有效ASCT至关重要?
HSPC在发育过程中及成年阶段维持并重新注入血液。化疗会杀死这些快速分裂、自我更新的细胞及其衍生物,包括白细胞、红细胞和血小板(3)。
对于患有多发性骨髓瘤等血液癌症的患者来说,化疗或放疗后的HSPC移植能大大提高他们的总生存率。临床医生可以从移植受者或匹配供者的骨髓或外周血中采集移植物。尽管成年阶段的HSPC主要存在于骨髓中,但血液移植更为常见(3,4)。
骨髓采集更为痛苦,并且是侵入性的,通常需要在麻醉后进行手术。然而,血液采集几乎没有痛苦,这使得非亲缘供者更容易接受采血过程,而一些研究表明,从供者或患者身上采集外周血移植物,移植过程更快,而且更容易成功(5)。
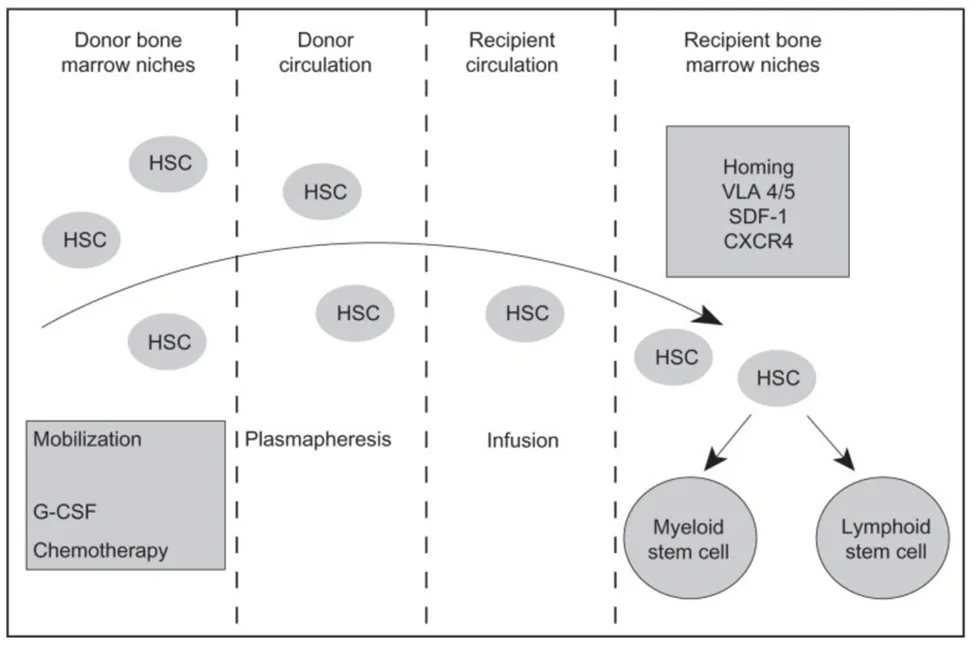
Hatzimichael & Tuthill (2022)论文中的图1概述了造血干细胞(HSC)从骨髓到血液的动员过程,以及输注后HSC向受者骨髓的归巢过程,图中包含参与此过程的关键分子;vLA-4/5,极晚期活化抗原;SDF-1,基质细胞衍生因子-1;G-CSF,粒细胞集落刺激因子。
无论移植物来源于哪里,疗效最终取决于可收集细胞的数量和质量,而目前的干细胞动员策略往往无法动员足够的细胞。例如,在采用G-CSF(目前标准的HSPC动员疗法)治疗后,只有40-50%的MM患者能收集到足够数量的HSPC (6)。
✔ motixafortide促进HSPC动员的作用机制如何?
科学家们通过单采术从MM患者的血液中收集HSPC,单采术(apheresis)是一种分离血浆和细胞的过程。当细胞表面受体CXCR4未被占用时,HSPC会被动员至外周血;而当CXCL2与受体结合时,HSPC会留在骨髓中(7)。motixafortide是一种多肽抑制剂,能与CXCR4结合并抑制CXCL2结合,从而促进HSPC动员至外周血中。由于motixafortide对CXCR4受体具有高亲和力且长效作用,因此它是一种特别有潜力的CXCR4抑制剂(1)。换句话说,CXCR4抑制剂plerixafor也能改善HSPC动员,但它对CXCR4受体的亲和力低,作用时间短(8)。
✔ HSPC动员能力的提高是否会改善ASCT的结局?
不一定。如果临床医生能更快地动员更多患者的更多HSPC,ASCT就能更容易进行,但不一定更有效。动员的HSPC类型似乎与移植细胞的数量同样重要,甚至更重要。
研究人员以往认为,细胞表面蛋白CD34+足以作为免疫表型标志物,用于外周血中的HSPC分选。然而,使用流式细胞术和scRNA-seq来分析临床样本的研究表明,CD34+ HSPC具有高度异质性,有些细胞亚群可能更适合ASCT,特别是原始HSPC——这些干细胞能够长期自我更新,同时保持分化成各种造血细胞的能力(9)。
以往的研究表明,plerixafor动员了多种CD34+ HSPC亚群,包括原始和多能HSPC,但还没有深入表征这些亚型及其对接受ASCT的患者的长期结局有何影响。motixafortide等CXCR4抑制剂是否能够动员更原始的HSPC,目前尚无定论,需要更深入了解。这项临床研究测试了motixafortide和G-CSF的联合治疗,属于深入探究此类药物能够动员哪些细胞群的首批研究之一。
✔ 临床结果
18个机构的122名MM患者被随机分配,接受motixafortide + G-CSF治疗(80人)或安慰剂+ G-CSF治疗(42人)。在接受motixafortide治疗的患者中,92.5%的参与者在第二天单采后收集到最佳数量的干细胞用于ASCT(≥6 x 106个CD34+),达到了主要终点。88%的患者在治疗后仅需一天的单采,达到了次要终点。在接受安慰剂治疗的患者中,只有47%的患者在单采四天后达到了主要终点,相比之下,接受motixafortide治疗的患者无一人需要第四轮单采。在单用G-CSF或联用motixafortide + G-CSF治疗后,移植HSPC的参与者在ASCT后100天的移植物持久性、无进展生存期和总生存期没有明显差异。
尽管与传统的G-CSF治疗相比,从接受试验性联合疗法治疗的参与者中收集HSPC并移植后的生存率似乎没有提高,但研究人员认为,对采集自临床试验参与者的样本进行单细胞分析后,结果表明这种新的动员疗法将会长期改善MM患者的生存率。
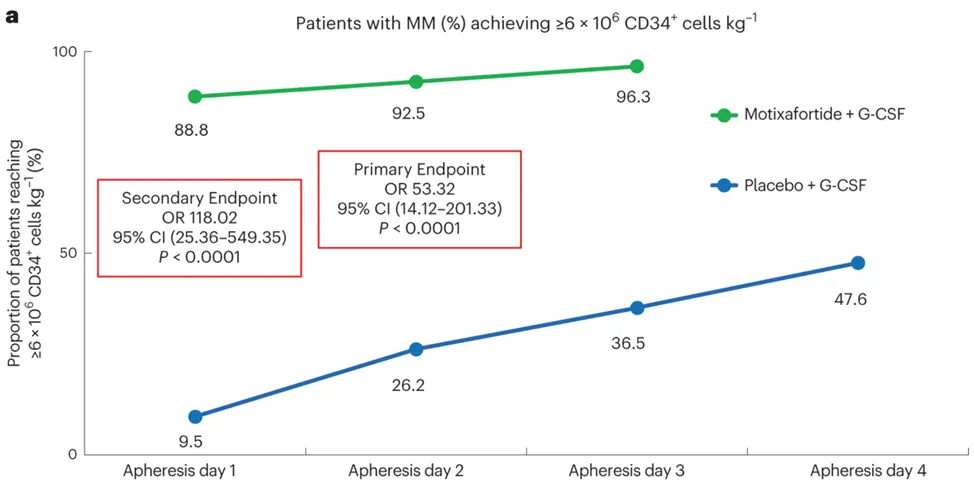
Crees等人论文(1)中的图2A强调,与安慰剂+ G-CSF相比,motixafortide + G-CSF在动员HSPC方面的效果显著提高。
✔ 单细胞测序的应用
作者采用Chromium单细胞5’ 基因表达分析来鉴定12名MM患者临床样本中CD34+ HSPC亚群的种类和分布,特别是原始HSC,以了解临床试验中观察到的motixafortide + G-CSF改善HSPC动员的机制,这些患者接受了motixafortide + G-CSF、plerixafor + G-CSF或安慰剂+ G-CSF治疗。
他们还分析了6名接受motixafortide、plerixafor或G-CSF治疗的健康供者(未患MM)的临床样本,以便进一步阐明motixafortide动员的细胞群体。截至2019年,约80%的造血干细胞移植使用的是采集自非亲缘供者的样本,因此研究motixafortide在健康个体中的疗效势在必行。
研究人员使用统一流形逼近和投影(UMAP)聚类,根据已知的谱系标志物鉴定出20个转录上不同的CD34+ HSPC亚群。作者将下游分析的重点放在6个转录图谱与造血干细胞相似的细胞亚群上。
研究人员随后确定了每个细胞亚群处于分化过程中的哪个阶段,从造血干细胞到成熟的谱系细胞(如淋巴细胞和红细胞)。scRNA-seq分析的独特之处在于能够鉴定出细胞的瞬时状态,其中基因正受到迅速、动态地调控,让细胞进入下一个稳定的细胞状态(比如从造血干细胞到髓系祖细胞)。
流式细胞术等传统方法难以分离这些处于瞬时状态的细胞,只能根据蛋白质(主要是细胞表面蛋白)对细胞进行分选。免疫学家通常使用CD34+ 等细胞表面蛋白对免疫亚群进行分类。不过,从一种细胞类型转变为另一种(比如从HSC转变为HPC)时,细胞表面标志物不会发生显著变化,因此无法检测到这些瞬时状态。然而,单细胞测序让研究人员能够分析样本中活跃分化细胞的单细胞转录本水平,为他们提供解析瞬时细胞状态所需的分辨率。
例如,造血干细胞的经典分化示意图往往展示了各种分化轨迹,包括干细胞分化为淋巴系祖细胞,后者又分化为自然杀伤细胞和淋巴细胞(详见图1)。不过,从图中一种细胞到另一种细胞的箭头却无法捕获细胞为达到目的而进行的无数次微小转录调整。
研究人员采用软件分析工具Monocle 3来开展拟时间轨迹分析,预测细胞在特定时间点处于分化过程中的哪个位置(10)。简单来说,Monocle 3使用一种算法来学习原始干细胞分化为谱系定向细胞时发生的基因表达变化顺序,从而开展拟时间轨迹分析。一旦算法掌握了基因表达变化的整体“轨迹”,它就能确定每个细胞在轨迹中的位置。
此次分析预测,细胞亚群HSC1是转录上最原始的细胞,分化为HSC2-6和髓系祖细胞(MLP)。其余亚群来源于HSC6或MLP。
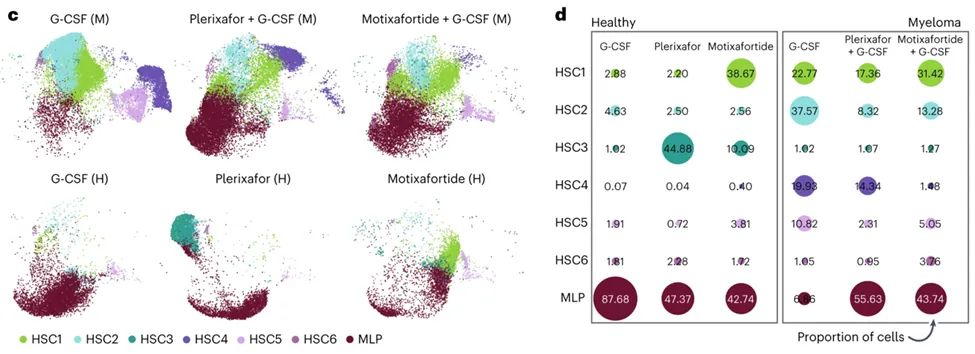
Crees等人论文中的图4C显示了各个队列和动员方案中的早期祖细胞群(HSC1-6和MLP)的UMAP图,其中每个细胞按细胞类型注释着色,并按动员方案和队列分开(M,多发性骨髓瘤;H,健康的异基因供者)。图4D显示了每个治疗组和队列中每个样本的细胞类型平均比例。圆点大小表示相对平均表达量,并叠加精确值。
细胞在这七种细胞状态下所做的微小调整导致不同队列和治疗组之间的细胞组成有巨大差异。在仅接受motixafortide治疗的健康供者样本中,原始HSC1细胞的比例超过25%,而在仅接受plerixafor或G-CSF治疗的样本中,原始HSC1细胞的比例不足2%。对于MM患者,接受motixafortide + G-CSF治疗后的HSC1细胞比例(31.42%)高于接受plerixafor + G-CSF治疗(17.36%)或安慰剂+ G-CSF治疗(22.77%)的细胞比例。
比较不同动员方案和供者类型的CD34+ HSPC亚群的差异基因表达分析证实,与接受plerixafor或G-CSF治疗的患者相比,接受motixafortide治疗的患者体内的HSC1群体丰度更高。
具体来说,在接受motixafortide治疗的患者中,他们发现以往与静息状态、HSC维持和自我更新相关的基因表达增加。基因集富集分析证实了这些结果,揭示了与造血再生和再生潜能相关的关键通路中的信号转导增加。
总的来说,scRNA-seq分析表明,motixafortide动员了细胞亚群的有利组成,这种组成可能与长寿命的HSPC有关,可提高ASCT疗效。尽管临床研究的结果并未发现使用motixafortide + G-CSF或仅使用G-CSF来动员HSPC的移植受者在ASCT后100天的移植物持久性或患者生存率上存在显著差异,但作者指出,这些结果给他们带来了希望,说明这种突破性的动员疗法将转化为ASCT疗效的整体提高。
圣路易斯华盛顿大学医学院的医学教授兼基因和细胞免疫治疗中心主任John DiPersio博士表示:“队列分析不是为了解潜在临床结局而设计的;尽管如此,我们认为这些发现很有意义,值得进一步研究。”他也是GENESIS研究的首席研究员。
我们现已推出全新GEM-X单细胞解决方案,可实现更高的灵敏度、通量、数据质量和样本回收率!
欢迎扫码联系我们询价或了解更多信息

参考资料:
1.Crees ZD, et al. Motixafortide and G-CSF to mobilize hematopoietic stem cells for autologous transplantation in multiple myeloma: a randomized phase 3 trial. Nat Med 29: 869–879 (2023). DOI: 10.1038/s41591-023-02273-z
2.https://www.prnewswire.com/news-releases/biolinerx-announces-fda-approval-of-aphexda-motixafortide-in-combination-with-filgrastim-g-csf-to-mobilize-hematopoietic-stem-cells-for-collection-and-subsequent-autologous-transplantation-in-patients-with-multiple-myeloma-301923206.html
3.https://www.cancer.gov/about-cancer/treatment/types/stem-cell-transplant#:~:text=in%20clinical%20trials-,Types%20of%20cancer%20treated%20with%20stem%20cell%20transplants,used%20to%20treat%20certain%20cancers
4.Hatzimichael E & Tuthill M. Hematopoietic stem cell transplantation. Stem Cells Cloning 3: 105–117 (2022). DOI: 10.2147/SCCAA.S6815
5.https://ashpublications.org/ashclinicalnews/news/5761/Marrow-or-Peripheral-Blood-for-Allogeneic
6.Demirer T, et al. Factors influencing collection of peripheral blood stem cells in patients with multiple myeloma. Bone Marrow Transplant 17: 937–941 (1996).
7.Broxmeyer HE, et al. Rapid mobilization of murine and human hematopoietic stem and progenitor cells with AMD3100, a CXCR4 antagonist. J Exp Med. 201: 1307-18 (2005). DOI: 10.1084/jem.20041385.
8.DiPersio JF, et al. Plerixafor and G-CSF versus placebo and G-CSF to mobilize hematopoietic stem cells for autologous stem cell transplantation in patients with multiple myeloma. Blood 113: 5720–6 (2009). DOI: 10.1182/blood-2008-08-174946.
9.Schroeder MA, et al. Mobilization of allogeneic peripheral blood stem cell donors with intravenous plerixafor mobilizes a unique graft. Blood 129: 2680–2692 (2017). DOI: 10.1182/blood-2016-09-739722
10.https://cole-trapnell-lab.github.io/monocle3/docs/trajectories/