
-

生物通官微
陪你抓住生命科技
跳动的脉搏
单细胞RNA测序助力区分转移性黑色素瘤细胞治疗中的应答者和无应答者
【字体: 大 中 小 】 时间:2024年04月24日 来源:10x Genomics
编辑推荐:
在这篇文章中,我们将讨论研究人员如何对治疗前后的肿瘤活检样本进行全面的单细胞分析,这些样本来自肿瘤浸润淋巴细胞过继细胞疗法(TIL-ACT)I期临床研究招募的转移性黑色素瘤患者。
提高临床试验的成功率需要正确设计试验,通常还包括确定生物标志物,以便调整患者群体,明确药物疗效和安全数据,并最终指导未来的药物开发工作。
在“值得关注的临床试验”系列文章中,我们将重点介绍单细胞多组学和空间基因表达在各个试验阶段的临床样本中的创新应用。欢迎关注这一系列文章,了解我们的工具如何帮助研究人员揭示可预测治疗应答的稀有细胞群、可改善患者分层的生物标志物或新的作用机制。
在这篇文章中,我们将讨论研究人员如何对治疗前后的肿瘤活检样本进行全面的单细胞分析,这些样本来自肿瘤浸润淋巴细胞过继细胞疗法(TIL-ACT)I期临床研究招募的转移性黑色素瘤患者。
研究结果于今年2月发表在《Science Immunology》杂志上,表明基线和治疗后的免疫细胞状态以及肿瘤微环境内的细胞间相互作用决定了对治疗的积极应答,并指出了一种可能的生物标志物,有望改善TIL-ACT的患者选择(1)。下面我们将详细介绍这项临床试验的目标和结果。
I期:肿瘤微环境中T细胞-髓系细胞网络驱动过继细胞疗法的成功
癌症类型:转移性黑色素瘤
疗法:采用离体扩增的肿瘤浸润淋巴细胞(TIL)过继细胞疗法(ACT)(又称为TIL-ACT),根据患者耐受性与大剂量白细胞介素-2(IL-2)联用,然后对符合条件的患者进行nivolumab(PD1单克隆抗体)治疗。
试验目标:确定TIL-ACT治疗转移性黑色素瘤患者的可行性和安全性,次要目标是确定TIL-ACT治疗后采用nivolumab治疗的可行性和安全性。
领导结构:洛桑大学Ludwig癌症研究所;洛桑大学医院;Agora癌症研究中心;CHUV-Ludwig癌症研究所合办的细胞治疗中心
合作制药机构:百时美施贵宝
ClinicalTrials.gov注册编号:NCT03475134
临床结果:在免疫检查点阻断(ICB)治疗后出现病情进展的13例转移性黑色素瘤患者在清淋化疗后接受了TIL-ACT和静脉注射IL-2支持治疗。研究团队观察到6例患者出现客观缓解,因此46%的患者被标记为应答者。其中,2例患者表现出持续完全缓解,另外4例患者为部分缓解。无应答者分为疾病进展患者(4例)和疾病稳定患者(3例)。13例患者的中位无进展生存期为5.6个月,中位总生存期为8.8个月。值得注意的是,2例完全缓解患者在TIL-ACT治疗前接受了单ICB治疗,而4例部分缓解患者和7例无应答者中的6例在试验前接受了双ICB治疗。
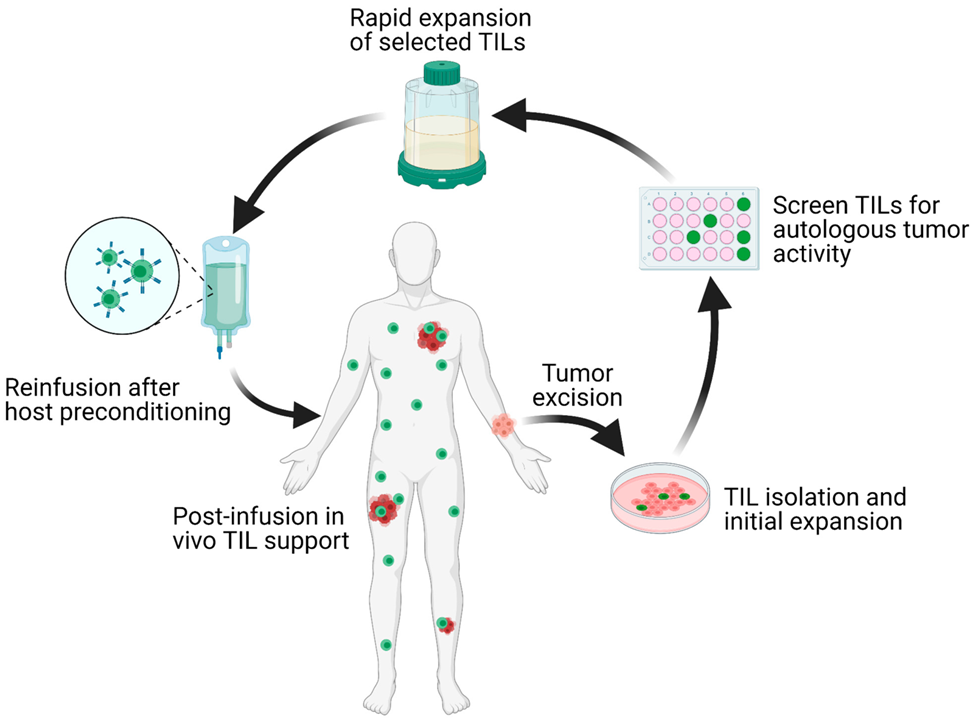
TIL-ACT治疗方案示意图。转移性肿瘤患者接受一处病灶的转移灶切除,然后将肿瘤消化为多个小肿瘤片段或单细胞悬液。加入IL-2,对肿瘤片段进行体外培养,完成初次的TIL分离和扩增。将分离出的TIL与自体消化的肿瘤细胞共培养,通过IFN-γ ELISA分析评估IFN-γ的分泌,以此来筛选TIL的肿瘤反应性。之后在CD3单克隆抗体、IL-2和经过辐照的自体滋养细胞存在的情况下,对肿瘤特异性TIL克隆进行巩固和快速扩增。一旦TIL的数量达到治疗水平(通常大于1 × 10^10个细胞),就可以收集细胞,并通过单次输注将它们转移回清淋的宿主体内。图片来源:实体瘤的ACT疗法,学术社区百科全书,https://encyclopedia.pub/entry/9312 (CC BY 4.0)。
✔ 什么是肿瘤浸润淋巴细胞的过继细胞疗法?
这种疗法利用患者的内源性T细胞,这些T细胞已成功浸润肿瘤,因此能广泛识别肿瘤细胞上的抗原。TIL可能因肿瘤微环境不利而变得无效,因为肿瘤微环境中富含抑制性的调节性T细胞或髓系抑制细胞;然而,这种疗法允许科学家从采集的肿瘤中分离出TIL,进行离体扩增,然后将细胞回输到患者体内。在TIL-ACT之前通常先采用清淋化疗方案,目的是清除肿瘤微环境中的调节性T细胞或细胞因子,因为它们会抑制TIL的抗肿瘤免疫力和增殖潜力(2)。
✔ 为什么考虑对这些患者使用TIL-ACT?在免疫检查点阻断疗法不再有效的情况下,TIL-ACT有哪些额外的优势?
Ludwig癌症研究所的研究人员与CHUV-Ludwig研究所和洛桑大学医院的科学家们合作,在这项临床试验中探索了TIL-ACT,因为在之前的临床研究中,TIL-ACT对转移性黑色素瘤患者表现出疗效(1)。这种疗效的历史可以追溯到1988年,当时研究人员首次对转移性黑色素瘤患者进行肿瘤浸润淋巴细胞的过继细胞疗法人体试验,发现客观缓解率达到55% (2)。值得注意的是,2020年的一项TIL-ACT临床研究显示,PD-1阻断治疗或BRAF±MEK抑制剂治疗后病情进展的黑色素瘤患者表现出更高的阳性应答,包括36.4%的客观缓解率和80%的疾病控制率。在这个案例中,对过继细胞疗法有应答的大多数患者在接受ICB治疗后都出现了进展,表明这两种免疫疗法并非多余。与ICB疗法相比,TIL-ACT可能具有优势,因为ICB依赖于肿瘤微环境中肿瘤反应性T细胞的存在;然而,这些关键细胞可能会功能失调或丰度不够(或根本不存在)。与此相反,TIL-ACT可选择出肿瘤抗原特异性T细胞并重新引入,再结合IL-2共培养和清淋策略,也许能克服肿瘤微环境中的功能障碍诱因(2)。
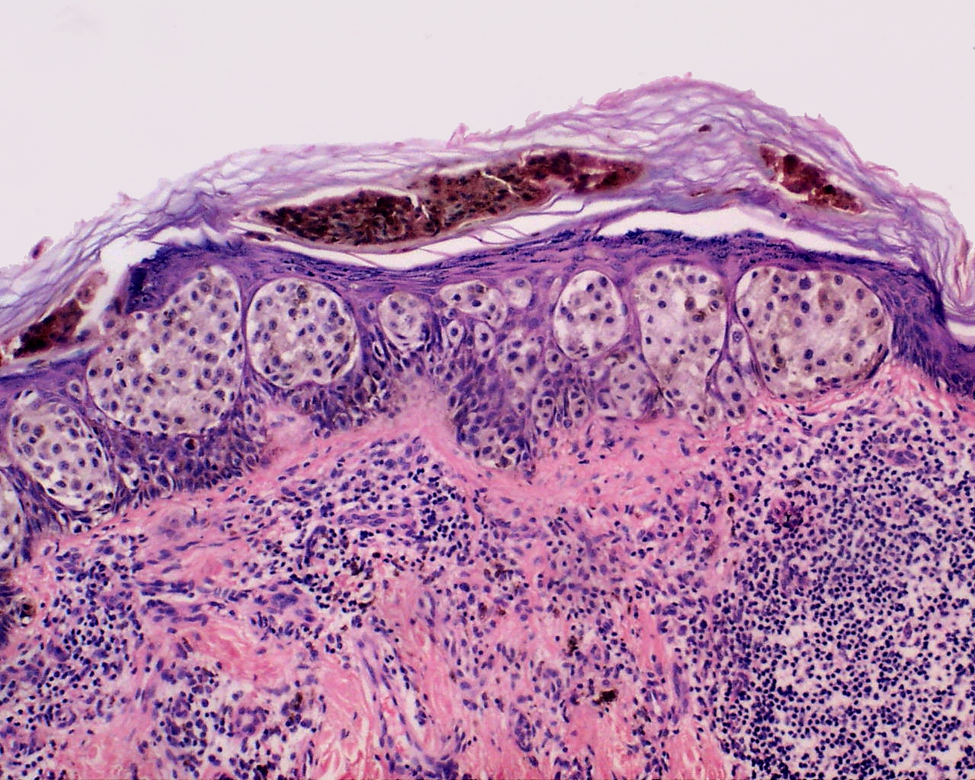
H&E染色结果显示皮肤活检中的黑色素瘤。图片来源:Wozniak L & Zielinski KW自行拍摄(CC BY-SA 3.0)。
✔ 单细胞测序的应用:建立肿瘤内在特征基线
考虑到肿瘤微环境(TME)和肿瘤内在特征对过继细胞治疗效果的影响,研究团队试图利用单细胞RNA测序来建立患者肿瘤的基线细胞景观。这些见解有助于他们确定影响治疗效果的肿瘤内在因素,以及区分可能的应答者和无应答者的生物标志物。
研究团队首先通过单细胞RNA测序分析了10例患者在TIL-ACT前的手术样本,包括6例应答者和4例无应答者。具体来说,他们对切除的肿瘤进行解离,并通过Chromium单细胞3’基因表达分析来生成主要细胞类型及其比例的UMAP投影图。每个样本的肿瘤细胞都单独聚类,这表明患者的特异性很高。研究团队利用单细胞数据推断恶性肿瘤细胞的染色体拷贝数变异后,发现应答者存在更多的拷贝数缺失,表明这些肿瘤细胞的基因组不稳定性更高。与无应答者的肿瘤细胞相比,应答者的肿瘤细胞还显示出多个免疫原性程序的激活,包括IFN-α和IFN-γ反应、补体激活、抗原呈递和免疫检查点。
✔ 单细胞测序的应用:表征TIL-ACT之前的肿瘤浸润T细胞群
为了进一步表征TME的免疫细胞组成,研究团队从所有13例患者的肿瘤样本中分离出CD45+细胞,并采用Chromium单细胞5’基因表达和单细胞T细胞受体测序(scTCR-seq)对其进行分析。分析揭示了九个不同的CD8+ TIL簇,分别代表不同的T细胞状态,包括初始样、效应记忆、耗竭和自然杀伤(NK)样T细胞。
研究团队希望通过了解基线肿瘤中两组患者的肿瘤浸润T细胞状态之间的差异,进一步区分应答者和无应答者。在应答者中,他们观察到前体耗竭(PEX)和耗竭(TEX)CD8+ T细胞的富集,在所有T细胞状态中,这些细胞的T细胞受体(TCR)信号传导、细胞毒性和增殖相关基因特征最高,表明这些细胞群正在积极对抗肿瘤抗原。应答者的PEX和TEX CD8+ T细胞还显示出树突状细胞CD28共刺激的特征,这是一种已知的保持增殖能力的机制。与此相反,他们观察到无应答者的CD8+ T细胞在过表达病毒特异性的基因特征,这显示了旁观者表型。
接下来,研究团队探究了与阳性临床应答或TIL-ACT失败相关的特异性基线T细胞基因表达程序。他们发现,临床应答与ZNF831(锌指蛋白831)和HIVEP1(锌指蛋白40)活性增加的CD8+ TIL相关,这两种蛋白都与参与效应物和耗竭程序的基因的增强子元件结合。然而,TIL-ACT失败与基线状态存在初始样和记忆样CD8+ TIL有关,也与参与T细胞发育和分化的基因和转录因子的表达增强有关,这通常反映出缺乏抗原刺激过的肿瘤反应性T细胞群。
完全缓解和部分缓解也可能归因于基线TIL特征的差异。研究团队发现,在完全应答者的CD8+ TIL中,线粒体电位和功能以及电子传递链的基因表达通路升高,表明与部分应答者的TIL相比,这些细胞的代谢能力更强。这些特征使得T细胞在肿瘤微环境中维持更久的抗肿瘤活性,最终形成更好的长期临床应答。用汽车来打个比方,虽然有两辆同一型号的汽车,但其中一辆更适合在更远的距离、更恶劣的路况或天气条件下行驶。
综上,这些见解反映出,了解T细胞在肿瘤微环境中的状态极其重要,因为它们会影响病情进展和治疗应答。而且,它们最终也提醒人们,患者在TME细胞组成上的差异也是决定治疗应答的主要因素。
✔ 单细胞测序的应用:将免疫细胞串扰定义为治疗应答肿瘤的重要特征
除了定义肿瘤浸润淋巴细胞的特征外,研究团队还利用肿瘤微环境的全面单细胞分析来确定其他细胞类型是否会影响治疗应答。应答者的耗竭TIL比例相对于巨噬细胞和树突状细胞(髓系亚群)明显更高,对后者而言,与IFN信号传导、抗原呈递和CD28共刺激相关的转录程序表达上调。这些结果表明,TME中TIL、巨噬细胞和树突状细胞之间的串扰可能是TIL活化并最终形成积极治疗应答的一个促成因素。推断的细胞间相互作用表明,与无应答者相比,应答者的免疫细胞相互作用基线明显更高,尤其是CD8+ TIL与CD11c+髓系细胞之间的相互作用。这些结果显示,在建立强大的肿瘤反应性TIL群体和有效的TIL-ACT疗法时,T细胞与髓系细胞之间的相互作用是基础。
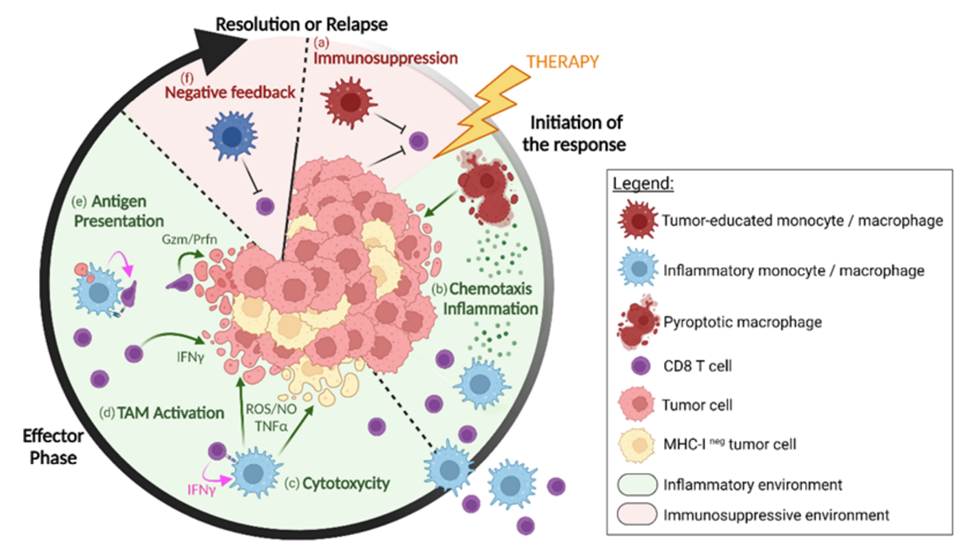
图中显示了免疫治疗后肿瘤消退过程中单核细胞/巨噬细胞与CD8+ T细胞之间不同程度的合作。在进展期肿瘤中,肿瘤教育的巨噬细胞有助于抑制CD8+ T细胞活性(a)。在免疫治疗后,巨噬细胞释放炎性细胞因子和趋化因子(b),同时巨噬细胞发生焦亡。它吸引并引导新的髓系细胞和CD8+ T细胞来浸润发炎的肿瘤。单核细胞/巨噬细胞被产生IFN-γ的CD8+T细胞激活后也能杀死肿瘤细胞(c),某些亚群可能通过抗原交叉呈递在局部重新激活CD8+T细胞(e),增加杀死肿瘤细胞的几率。随着肿瘤的消退,伴随着效应细胞激活的自然负反馈回路(f)会逐渐终止免疫反应。图片来源:Vermare A, et al. Dynamic CD8+ T cell cooperation with macrophages and monocytes for successful cancer immunotherapy. Cancers 14: 3546 (2022). https://doi.org/10.3390/cancers14143546. (CC BY 4.0).
✔ 单细胞测序的应用:通过治疗后的患者样本确定TIL-ACT的作用机制
治疗后的患者样本对于了解治疗如何发挥作用同样重要,因为它们开启了一扇窗口,让人们了解治疗如何改变肿瘤微环境的组成,包括相对于基线特征的关键免疫细胞比例或T细胞状态。在TIL-ACT治疗后至少30天后,研究团队获得了11例患者的治疗后肿瘤活检样本,并利用从单细胞数据中提取的基因表达特征开展批量细胞RNA测序分析,以区分主要细胞类型。分析结果显示,应答者和无应答者在治疗后的免疫细胞组成上存在明显差异:应答者重建了关键的CD8+ PEX和TEX T细胞特征,并表现出CXCL9+和ISG(干扰素刺激基因)巨噬细胞特征的增加。相比之下,无应答者则失去了肿瘤反应性T细胞群体的这些特征。
研究团队还从7例患者身上获得了更多活检样本,分离出CD45+细胞并开展单细胞5’基因表达和scTCR-seq分析。结果显示,治疗后,应答者的CD8+ T细胞与髓系亚群(特别是CXCL9+巨噬细胞)之间的预测相互作用增强。相比之下,无应答者的治疗后肿瘤样本同样没有显示出这些免疫细胞相互作用的证据。
总的来说,这些单细胞研究结果确立了TIL-ACT的作用机制,表明成功的治疗可能归因于TME中抗肿瘤TIL组库的恢复以及丰富的抗原呈递细胞网络,包括CXCL9+巨噬细胞。此外,研究团队的结果还表明,耗竭的CD8+ TIL和CD11c+髓系细胞亚群的基线存在可作为潜在的生物标志物用于患者选择。
这项研究标志着目前正在进行的改善实体瘤的细胞疗法工作向前迈出了重要一步。用作者的话来说,“对TME状态和动态以及细胞间相互作用组的详细表征将有助于促进ACT应答标志物的开发,并指导新一代的过继细胞免疫疗法,以实现最大的临床受益”。
10x Genomics现已推出全新GEM-X单细胞解决方案,可实现更高的灵敏度、通量、数据质量和样本回收率!
欢迎扫码联系我们询价或了解更多信息

参考文献:
1.Barras D, et al. Response to tumor-infiltrating lymphocyte adoptive therapy is associated with preexisting CD8+ T-myeloid cell networks in melanoma. Sci Immunol 9: eadg7995 (2024). doi:10.1126/sciimmunol.adg7995
2.Kirtane K, et al. Adoptive cellular therapy in solid tumor malignancies: review of the literature and challenges ahead. J Immunother Cancer 9: e002723 (2021). doi: 10.1136/jitc-2021-002723