
-

生物通官微
陪你抓住生命科技
跳动的脉搏
荧光点亮 RNA适配体RhoBAST结合与激活荧光团TMR-DN的机制
【字体: 大 中 小 】 时间:2024年05月22日 来源:中国科学院生物物理研究所
编辑推荐:
2024年5月17日,中国科学院生物物理研究所方显杨研究组与动物研究所李幸研究组合作在《Nature Communications》上发表了题为"Structural mechanisms for bind...
在活细胞中对生物大分子,如蛋白质和RNA等进行时空定位和追踪,对于理解它们的生物学功能和揭示其机制至关重要。绿色荧光蛋白的发现和开发显著提高了活细胞内功能性蛋白成像的适用性。目前,荧光点亮RNA适配体 (FLAP) 已作为荧光蛋白的对应物应用于细胞中功能RNA的成像。FLAP通常是利用体外进化筛选技术得到的一段RNA序列,其结合配体后能显著增强配体的荧光。由于其高亮度、更好的可编程性和较小的尺寸,FLAP被认为是强有力的活细胞RNA荧光成像工具。
近年来,RhoBAST、biRhoBAST、o-Coral、SiRA等一系列FLAP因其在RNA超分辨率成像中的优异表现而受到广泛关注。这些FLAP均可结合罗丹明的衍生物。罗丹明是一种荧光染料,以超高的光稳定性、亮度和良好的膜渗透性而广泛用于生物成像。研究表明,RhoBAST可以结合并激活一种接触淬灭型罗丹明衍生物TMR-DN (发光团TMR和淬灭剂DN的耦联化合物),因其良好的折叠性能、高亲和力、配体快速交换、超高亮度、优异的光稳定性等多种特征,在RNA的超分辨率成像中表现出优异的性能。然而,RhoBAST结合和激活荧光染料的结构机制还不清楚。
2024年5月17日,中国科学院生物物理研究所方显杨研究组与动物研究所李幸研究组合作在《Nature Communications》上发表了题为"Structural mechanisms for binding and activation of a contact-quenched fluorophore by RhoBAST"的研究论文。在该项研究中,研究人员通过整合X射线晶体学、小角X射线散射、分子动力学模拟等方法,揭示了RhoBAST的结构及其结合与激活TMR-DN的分子机制。
研究人员首先应用X射线晶体学解析了RhoBAST与TMR-DN复合物的高分辨率结构,发现RhoBAST折叠成一种四分支结构(four-way junction),整体结构类似于不对称的"A"字形(图a)。TMR的蒽杂环嵌入到位于"A"字形顶端的半开放结合口袋,而DN堆积在TMR的苯环上。有趣的是,尽管TMR-DN与RhoBAST的相对结合面积普遍要小于绝大多数的FLAPs (图b-c),但是RhoBAST与TMR-DN却有着较高的亲和力(KD ≈ 30 nM)。小角X射线散射实验表明RhoBAST的折叠不依赖于配体分子,这显著区别于绝大数的FLAP结构,通常这些FLAP的折叠依赖配体的结合。通过与其它FLAP的折叠结构和结合模式的比较,研究人员推测,可能由于RhoBAST的结合口袋远离折叠中心,因而其折叠不依赖配体。同时,这也赋予了RhoBAST结构的刚性,使其与TMR-DN的结合更像是锁-钥模式。类似的,一种识别花菁染料的适配体DIR2s也具有近似的结构特征(图b),也展示出不依赖配体结合的折叠模式。由于RhoBAST的结构刚性,它与配体结合过程中较少的构象熵损失弥补了它们之间相对较弱的相互作用,使其仍然具有较高的配体结合亲和力。RhoBAST的结构刚性以及半开放的结构口袋的特征可能还赋予它与配体快速交换的动力学性能,其要比其它FLAPs如pepper系统至少快两个数量级以上,因此可以通过与溶液中新鲜配体的快速交换来很好地避免光漂白问题,使其在荧光超分辨成像展现出优良的光学性质。
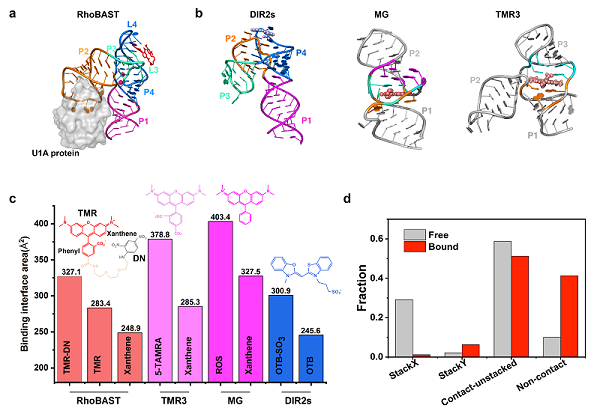
图:(a) RhoBAST-TMR-DN复合物的晶体结构示意图。(b-c) 其它代表性荧光RNA适配体复合物的结构和结合面积比较。(d) TMR-DN结合RhoBAST前后不同构象的统计。
为了更好地理解RhoBAST对TMR-DN的激活机制,研究人员采用增强采样的分子动力学模拟方法表征了TMR-DN在自由以及与RhoBAST结合状态下的构象空间。结果表明,无论是自由还是结合状态下,TMR-DN都呈现出一种高度动态的构象特征,其中接触-非堆叠构象占据所有接触类型中的多数(图d)。未结合状态下,淬灭剂DN与发光团TMR接触比例达到90%,DN偏向与其中的蒽杂环接触。此时绝大多数的TMR-DN处于自淬灭状态(荧光量子产率 ΦF=0.08)。与RhoBAST结合后,DN与蒽杂环的接触被抑制,其与TMR的接触比例显著下降到60%左右,因此只有部分TMR-DN被激发,这与之前文献报道该体系在结合状态下只有中等荧光量子产率(ΦF=0.57)的观测是大致相符的。
总之,该项工作通过整合多种研究方法揭示了RhoBAST的结构及其结合与激活一种荧光淬灭型荧光团TMR-DN的机制,进一步通过比较相关FLAP的结构和结合模式,为理性设计和优化这一重要的FLAP系统提供了机制见解。
中国科学院生物物理研究所方显杨研究员与动物研究所李幸研究员为该论文的共同通讯作者。生物物理所方显杨组研究助理张宇帆、清华大学生命学院博士生徐钟河和博士后肖裕、李幸组博士生蒋浩东为论文并列第一作者。美国阿贡国家实验室左孝兵博士为SAXS数据的收集做出了重要贡献。该研究得到国家重点研发计划、国家自然科学基金委等项目的资助。
文章链接:https://doi.org/10.1038/s41467-024-48478-9
 生物通微信公众号
生物通微信公众号
知名企业招聘