
-

生物通官微
陪你抓住生命科技
跳动的脉搏
不忘Protocol,方得Result——快来解锁「免疫组化」正确姿势!
【字体: 大 中 小 】 时间:2024年06月11日 来源:基因有限公司
编辑推荐:
免疫组化的实验步骤虽然比较简单,但是贵在精通,重在认真,要在细节。不忘Protocol,方得Result!今天就让我们一起解锁免疫组化实验中的细节问题。技术干货还不快快收藏!
免疫组化(Immunohistochemistry,IHC),是基于抗原与抗体特异性结合的原理,通过化学反应使结合抗体的显色剂显色来确定组织或细胞内的抗原,对其进行定位、定性及相对定量的研究,是生命科学研究中常用且重要的实验方法。
免疫组化的实验步骤虽然比较简单,但是贵在精通,重在认真,要在细节。不忘Protocol,方得Result!今天就让我们一起解锁免疫组化实验中的细节问题。技术干货还不快快收藏!
1. 标本固定——不仅仅是“切一切”和“泡一泡”
(1)温柔取材:
不要挤压组织,轻柔取材和镊取,尽量避开坏死区域。太大太厚的组织不利于均匀一致的固定,实质组织取材厚度应小于5mm。
(2)新鲜的固定液:
固定液10%中性缓冲福尔马林(NBF) 需新鲜配置,商用型固定液注意其标注的有效期,避免使用过期变质的固定液。
(3)充分及时地固定:
固定液要充足,其与组织的体积比最好大于等于20倍;取材后即刻固定。固定时需将瓶口封住,避免甲醛挥发。组织的固定时间不宜过长,一般过夜(12-24h)即可。
2. 修复大法——不仅仅是“煮一煮”
(1)微波炉修复:简单易行效果好,CST推荐使用微波炉完成修复。
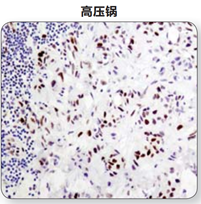
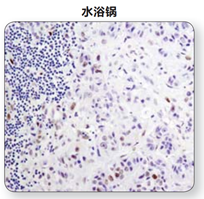
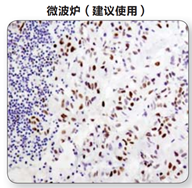
注:在利用水浴锅,微波炉或高压锅对抗原进行修复后,利用Phospho–Stat3 (Tyr705) (D3A7) XP® Rabbit mAb #9145 对石蜡包埋人类肺部肿瘤样本进行IHC分析。实验中,可见到使用微波炉和水浴锅修复结果的显著不同。对于一些抗体而言,使用高压锅得到的信号比使用微波炉得到的信号强度大。
(2)合适的修复液:根据抗体说明书使用合适的修复液。用柠檬酸修复后,切片需浸泡在修复液中,自然冷却;而用EDTA修复后,切片可直接从修复缸中取出,直接进行下一步。
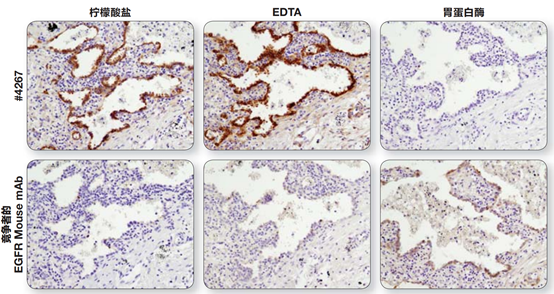
注:通过在柠檬酸盐缓冲液(左)、EDTA 缓冲液(中)中煮沸,或经胃蛋白酶 (右)消化,抗原修复后,利用EGF Receptor (D38B1) XP® Rabbit mAb #4267 和EGFR mouse mAb 对石蜡包埋人类肺部肿瘤进行IHC分析。对于#4267,经EDTA缓冲液修复的信号强度更强。然而,对于竞争者的EGFR mouse mAb,只有经胃蛋白酶消化后才可获得信号。
3. 对的抗体,对的使用——不仅仅是“买买买和加加加”
种属和应用范围:确定该抗体可检测所需种属的石蜡切片上完成组化实验(Application: IHC-P)。
稀释液和稀释比:查看抗体说明书,使用正确的一抗稀释液和稀释比。
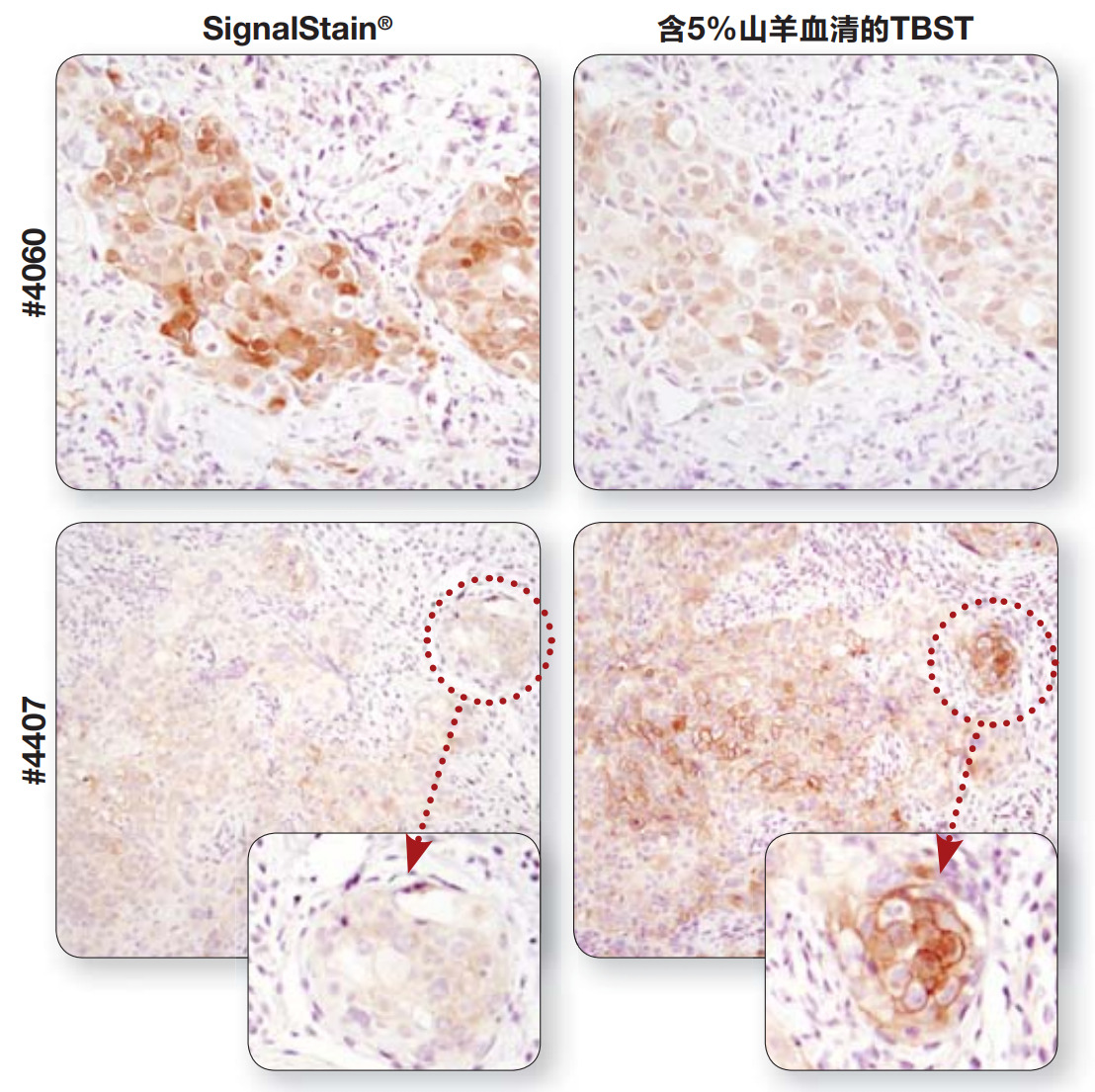
注:与#4060在TBST/5% NGS中稀释后所得的信号强度相比,经SignalStain® 抗体稀释液稀释后的信号强度更强;而对于#4407,选择TBST/5% NGS作为抗体稀释液的效果更好。
4. 匹配的二抗和显色系统——“配一配和滴一滴”
使用多聚HRP(Poly-HRP)的二抗,即在二抗上连接大量HRP,以充分放大信号;同时,配合优质的色原产品,提升灵敏度,增强信号。
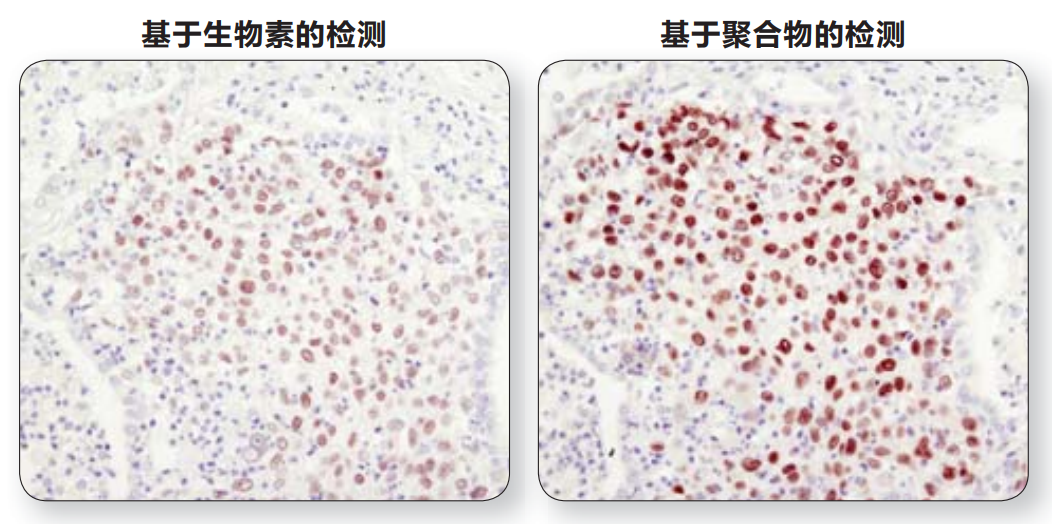
注:利用Sox2 (D6D9) XP® Rabbit mAb #3579 对石蜡包埋的人类肺部肿瘤进行IHC分析,采用基于生物素的检测(左)或基于聚合物的检测(SignalStain® Boost IHC Detection Reagent #8114;(右)。如图所示,基于聚合物的检测敏感度更高,染色强度更好。
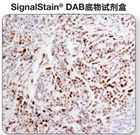
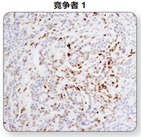
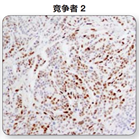
注:DAB色原比较:在人乳腺癌组织中使用p-Stat3(Tyr705)(D3A7)XP® Rabbit mAb#9145检测p-Stat3的表达,使用不同的产品进行显色。与竞争者的DAB产生的信号相比,SignalStain® DABSubstrateKit的显色强度更佳。
除了以上的Protocol细节问题外,免疫组化中的常见问题和解决方法我们也为你整理啦!一定能够帮到你!
1. 无染色或染色弱
(1)样本存放:
切片存放时间过长会导致没有信号,具体取决于靶标,不同的蛋白会存在各异的情况。由于无法对每一种蛋白验证、评估存放时间对于染色的影响,因此建议最好是使用新鲜制备的切片。如果确实需要储存切片,请将其置于4°C,储存时间取决于靶标,但也要尽快使用。此外,储存前请勿烘烤切片。
(2)组织切片干片:
在实验过程中除了特定的步骤,切忌干片,需要保持有液体覆盖其上。
(3)切片制备:
脱蜡不彻底会导致斑点出现以及不均匀的背景染色。建议使用新的二甲苯重新制备切片。
(4)抗原修复:
固定过的组织中的蛋白间会存在化学交联。取决于组织及蛋白,这会阻碍抗体和抗原的结合以及抗原表位的遮蔽。抗原修复这一步会用到热水浴、微波炉或压力锅。但不推荐使用热水浴来修复。更推荐使用微波炉来进行修复。
(5)抗原修复所用的缓冲液:
对特定组织或靶标抗原,其染色需使用经实验优化验证过的缓冲液。具体请参见每个产品说明书上注明的抗原修复缓冲液类型。另外,每次使用新鲜配置的1X修复液。
(6)抗体稀释比例及稀释液:
具体请参见每个产品说明书上注明的稀释比例和稀释液类型。若不是使用CST推荐的配套试剂的话,抗体的稀释比例需要自己摸索以找到最合适的使用量。
(7)孵育时间:
按照严格验证过的实验步骤进行抗体孵育会得到稳定、可重复的结果。CST的免疫组化一抗在开发和验证过程中为了得到最好的结果,一直使用的方法是4°C孵育过夜。
(8)检测系统:
验证结果发现,聚合物二抗检测系统如SignalStain® Boost IHC Detection Reagents (#8114)和(#8125), 与SignalStain® DAB Substrate Kit (#8059)搭配使用会得到比传统的ABC法灵敏得多的信号。此外,常见的偶联了HRP的普通二抗也不足以产生足够放大的信号。使用前还要查看产品是否过期。
(9)阴性结果:
若一点信号也没有,提示原因可能来自于抗体或实验过程。使用表达靶标的阳性参照样本如细胞团块石蜡包埋切片来进行实验,以找出原因所在。需要注意的是,磷酸化靶标或是表达量很低的靶标有时确实很难得到较好的染色,很有可能所用的样本中没有上述蛋白的表达。
2. 高背景
(1)切片制备:
脱蜡不彻底会导致斑点出现以及不均匀的背景染色。使用新的二甲苯重新制备切片。
(2)淬灭过氧化物酶:
如果使用HRP类的二抗系统,内源的过氧化物酶会导致额外的背景。在孵育一抗前使用3% H2O2(RODI水配置)淬灭10分钟。
(3)生物素封闭:
使用生物素类的二抗系统来检测如肾脏和肝脏等富含生物素的样本时会出现问题。在这些情况下,使用聚合物类检测系统, 如CST的SignalStain® Boost IHC Detection Reagents (#8114)和 (#8125)。那么,可以在常规的封闭步骤之后加上额外的生物素封闭的步骤。
(4)封闭:
使用恰当的封闭液进行封闭。若使用来自于山羊的二抗,那么在一抗孵育前,用含有5% Normal Goat Serum (#5425)的1X TBST (#9997) 封闭30分钟。
(5)抗体稀释比例及稀释液:
具体请参见每个产品说明书上注明的稀释比例和稀释液类型。若不是使用CST推荐的配套试剂的话,抗体的稀释比例需要自己摸索以找到最合适的使用量。
(6)二抗交叉反应:
在检测与二抗来源种属一样的样本时,由于二抗可能会结合内源IgG,因此会产生高背景。使用对照切片进行测试,在不加一抗仅加入二抗的情况下来确定是否高背景的原因是来自于此。
(7)清洗:
充分的清洗对于衬托强信号与低背景十分重要。在孵育一、二抗后分别清洗切片3次(每次5分钟)。
我们为您提供CST的与抗体配套使用的IHC试剂,同时为您提供免疫组化双染和多重荧光免疫组化(mIHC)解决方案!为您的实验保驾护航!
基因有限公司作为CST授权经销商,为您的实验提供优质的支持与帮助!欢迎添加产品专员了解更多信息!
