
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:通过空间转录组学揭示阿尔茨海默病中的小胶质细胞网络
【字体: 大 中 小 】 时间:2025年10月01日 来源:Molecular Neurodegeneration 17.5
编辑推荐:
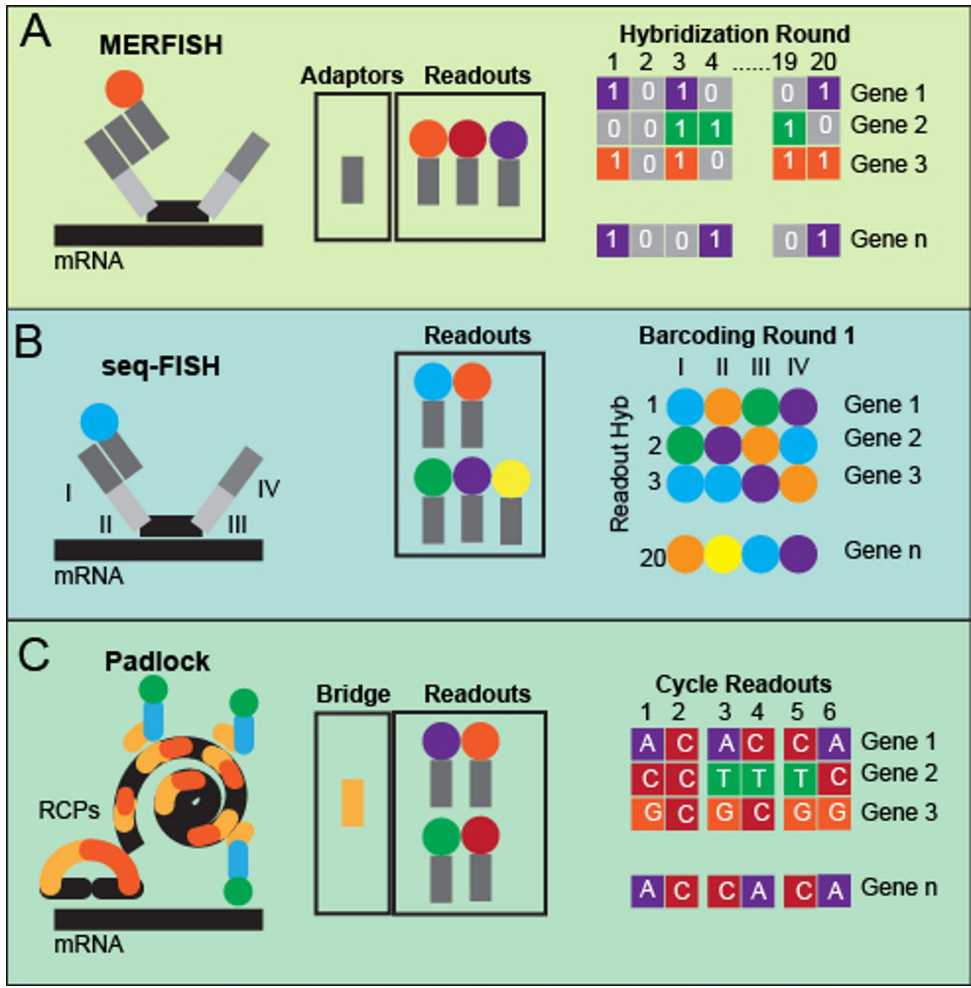
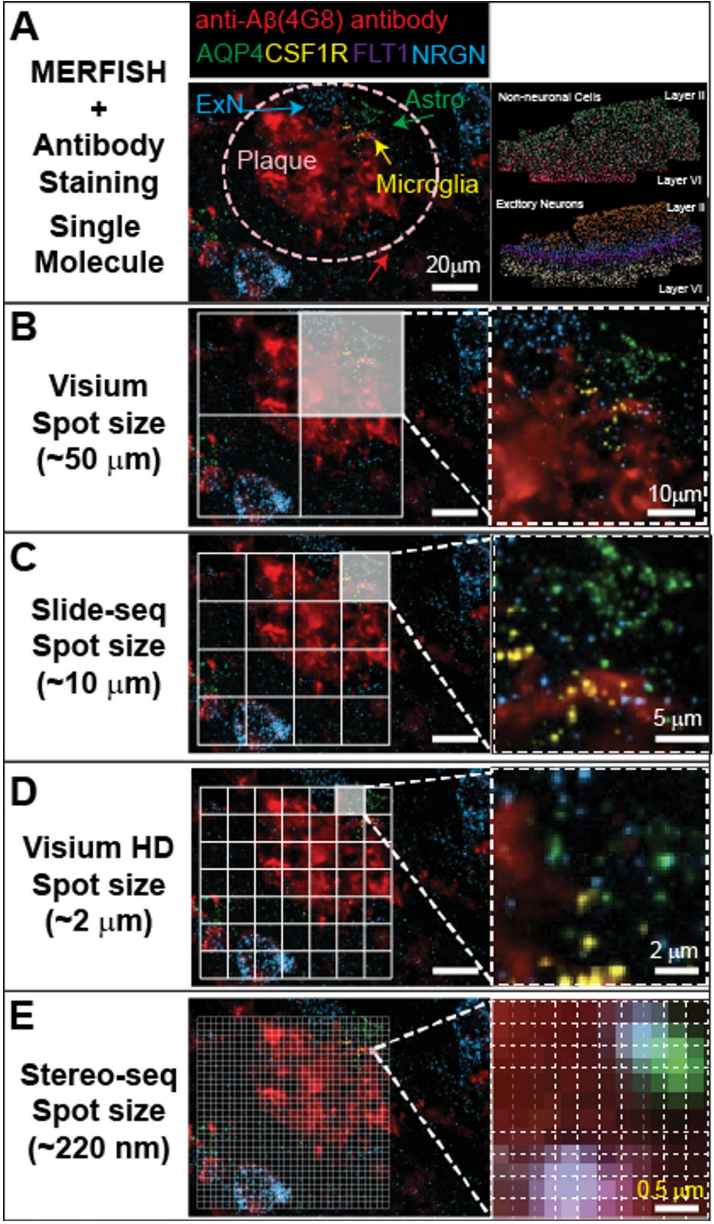
本综述系统阐述了空间转录组学(ST)技术如何揭示阿尔茨海默病(AD)中淀粉样斑块(Aβ)微环境内小胶质细胞(microglia)的区域异质性、功能多样性及其与星形胶质细胞(astrocytes)、神经元(neurons)和少突胶质细胞(oligodendrocytes)的动态相互作用。文章强调了小胶质细胞在衰老(aging)和AD进程中的核心作用,包括其与TREM2、ApoE等AD风险基因的关联,以及其作为潜在治疗靶点(therapeutic avenues)的价值。
 生物通微信公众号
生物通微信公众号
知名企业招聘