
-

生物通官微
陪你抓住生命科技
跳动的脉搏
噬菌体编码蛋白PavP通过双重抑制铜绿假单胞菌生长与毒力性状调控其致病性
【字体: 大 中 小 】 时间:2025年10月01日 来源:Biology Direct 4.9
编辑推荐:
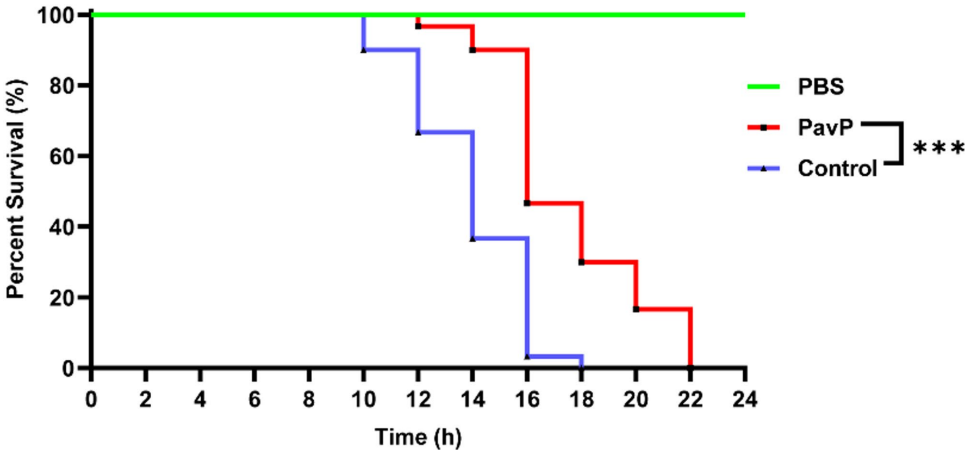
为解决多重耐药铜绿假单胞菌感染治疗难题,研究人员开展噬菌体编码蛋白PavP调控毒力机制研究,发现该蛋白在抑制细菌生长同时,通过诱导活性氧(ROS)积累、调控生物膜形成、运动性及III型分泌系统(T3SS)表达,显著减弱细菌致病性,为开发双功能抗菌剂提供新策略。
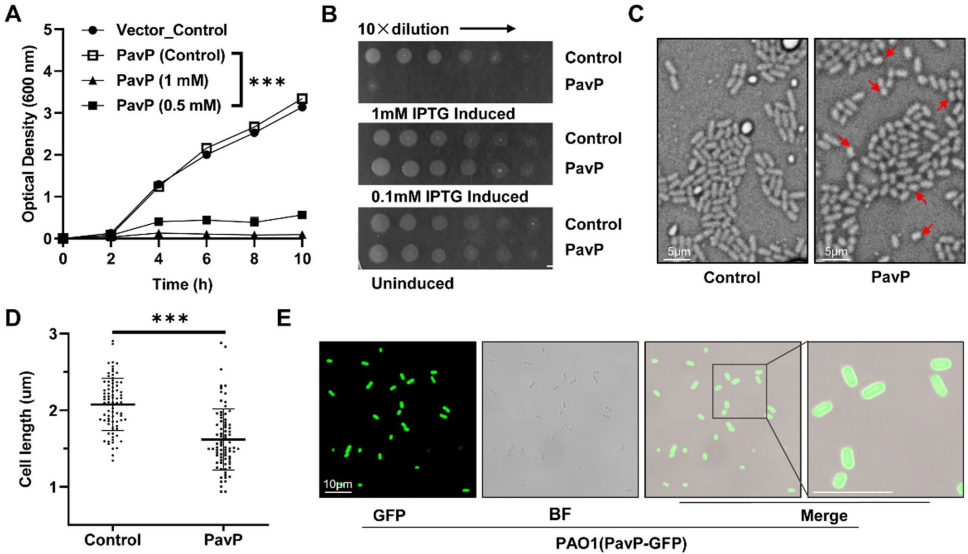
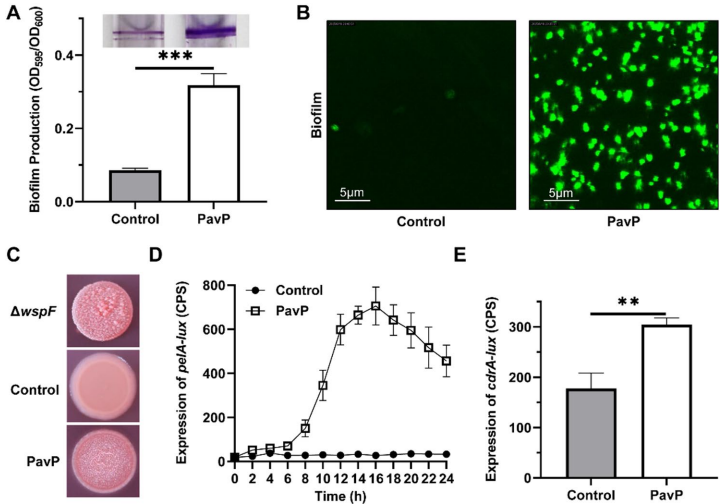
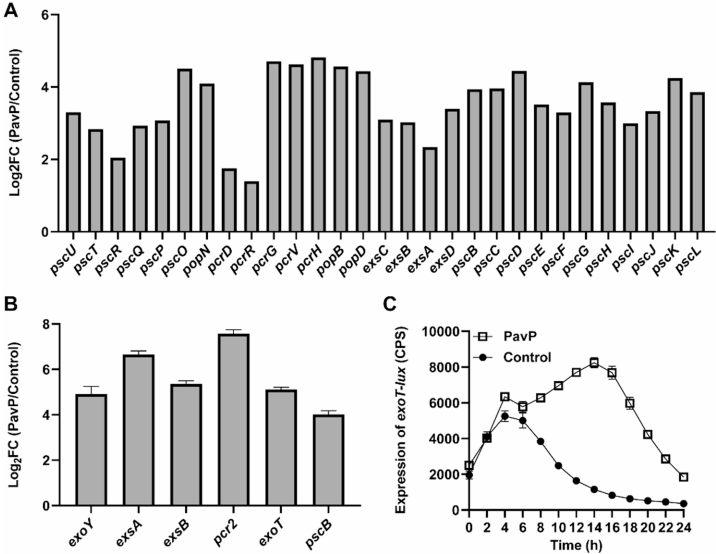
 p<0.01;*p<0.001).B and C Similar results were obtained from three independent experiments, and the image shown are from one representative experiment'>
p<0.01;*p<0.001).B and C Similar results were obtained from three independent experiments, and the image shown are from one representative experiment'>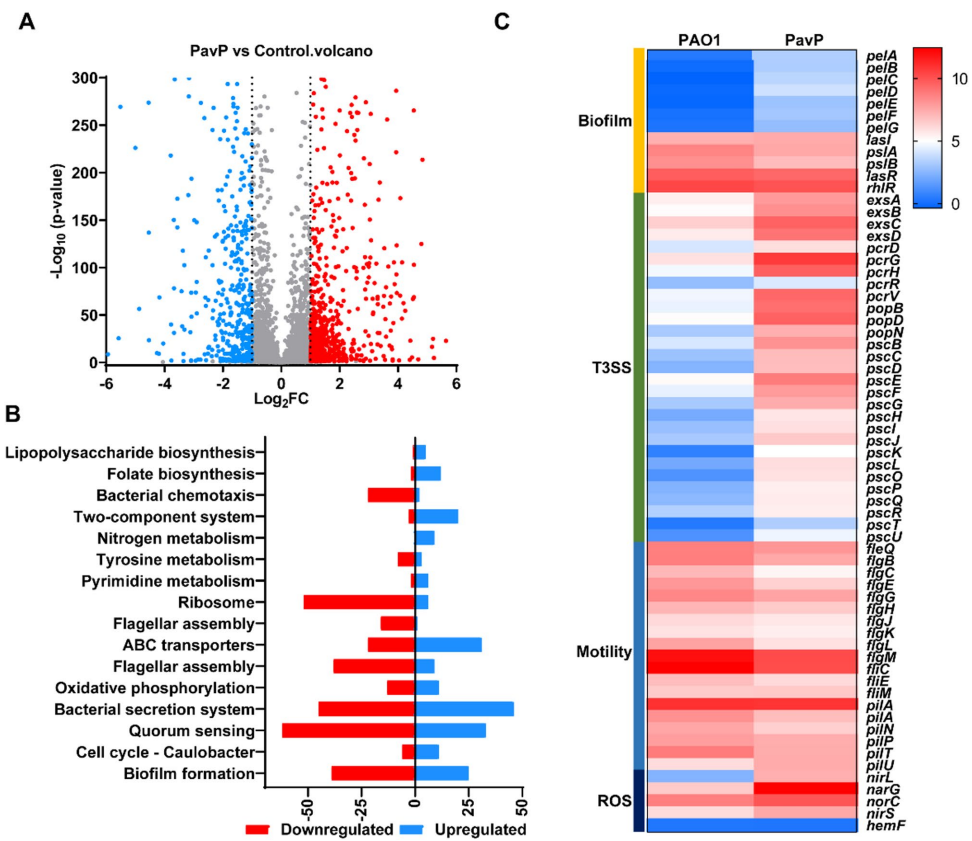

 生物通微信公众号
生物通微信公众号
知名企业招聘