
-

生物通官微
陪你抓住生命科技
跳动的脉搏
跨物种禽类胚胎干细胞系的成功建立及其在种系嵌合与生物多样性保护中的突破性应用
【字体: 大 中 小 】 时间:2025年10月01日 来源:Nature Biotechnology 41.7
编辑推荐:
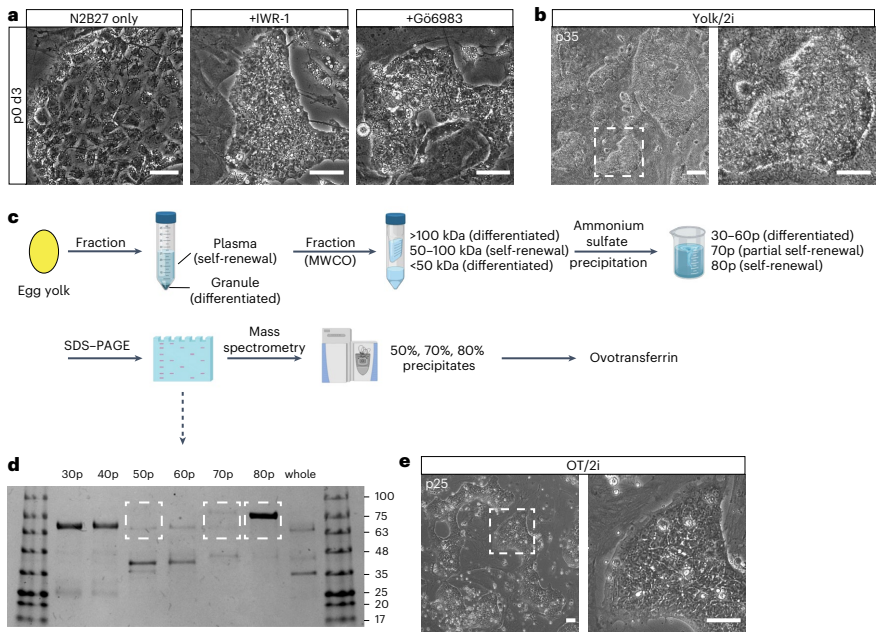
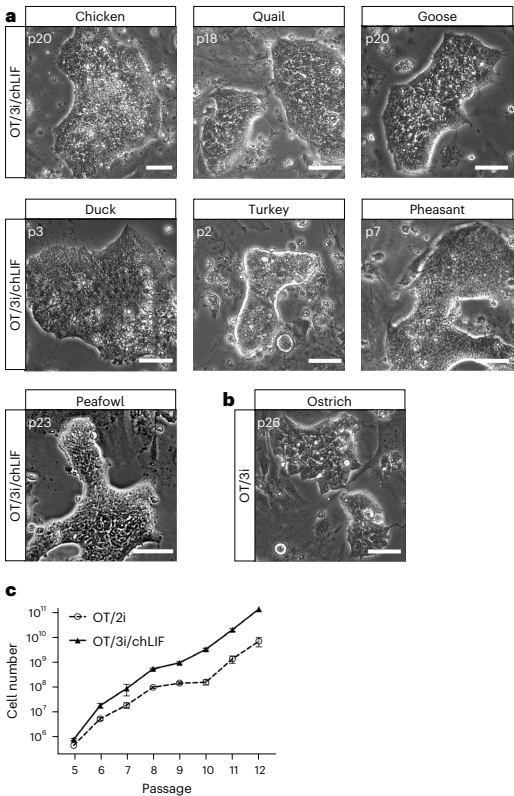
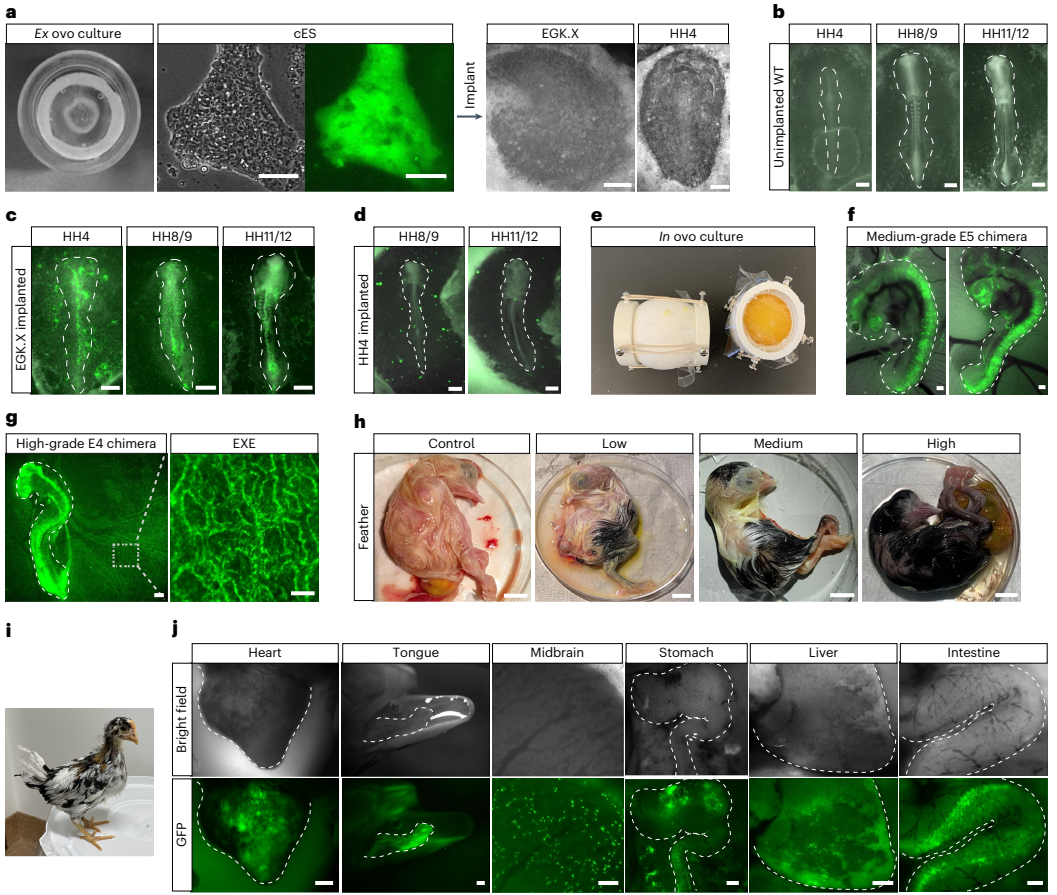
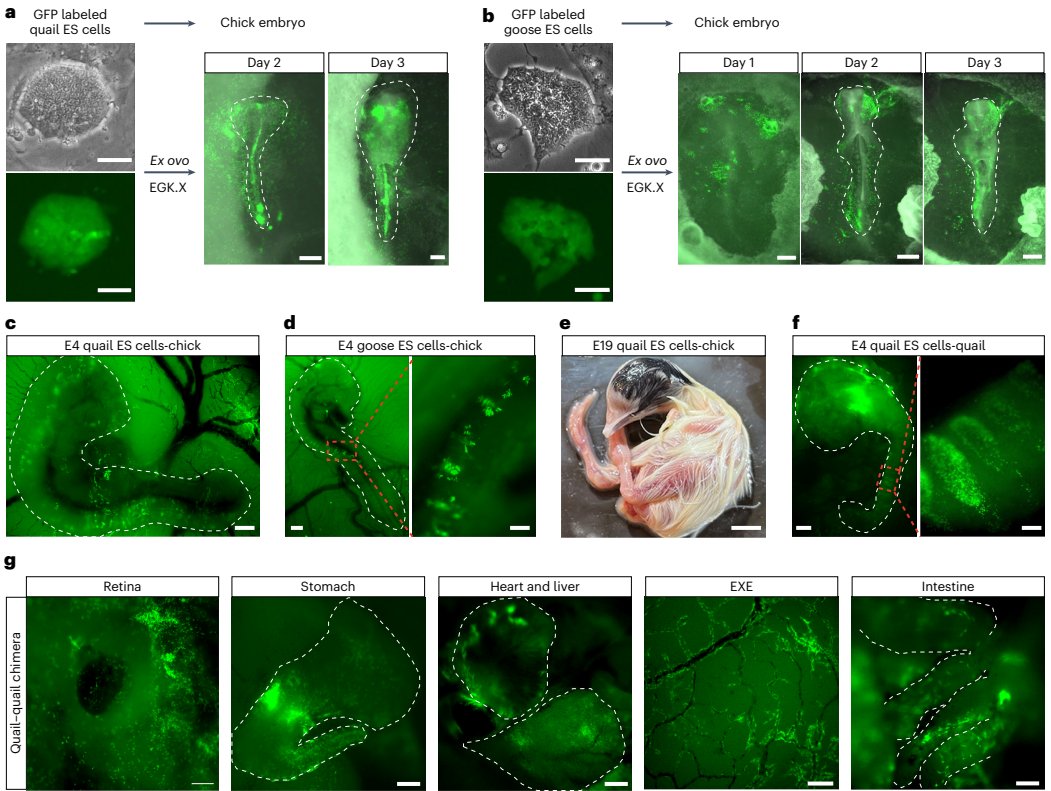
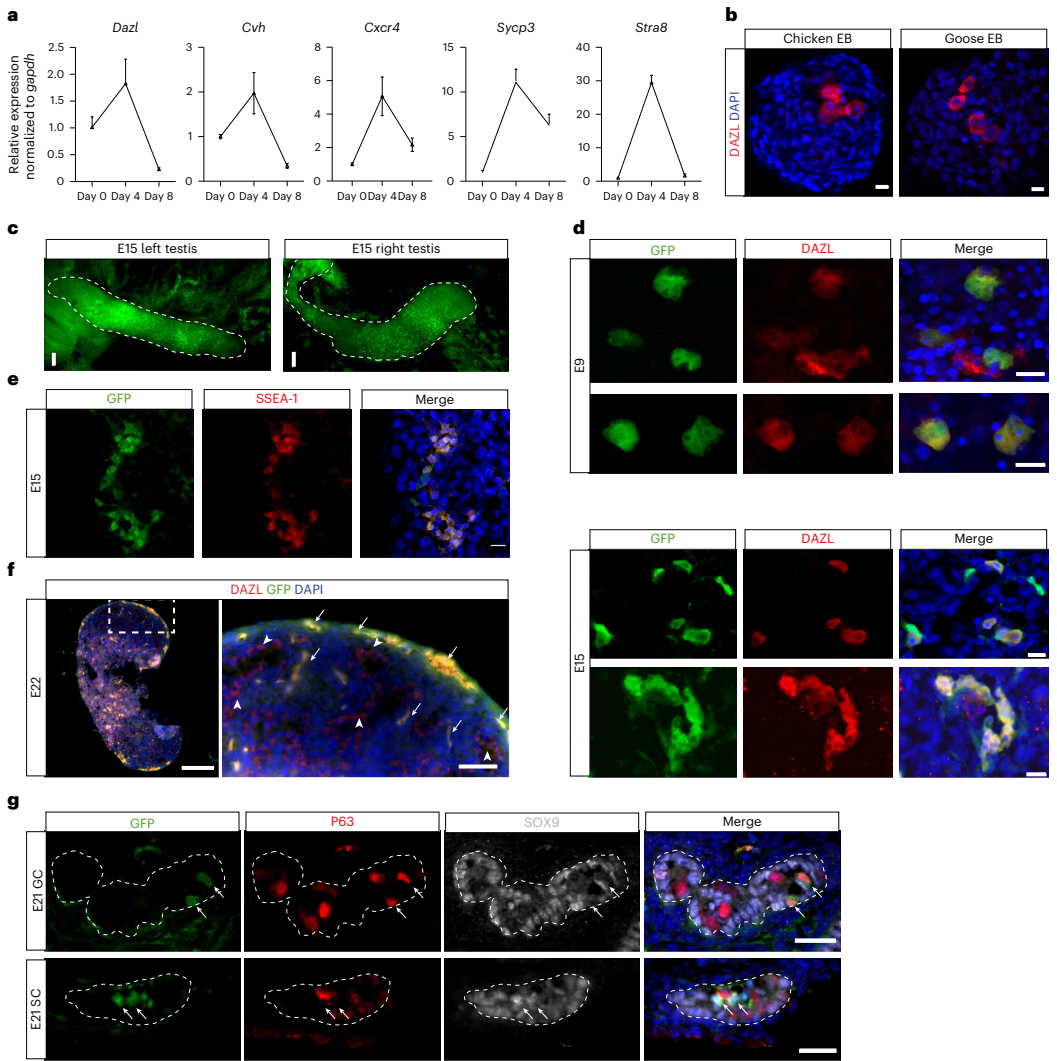
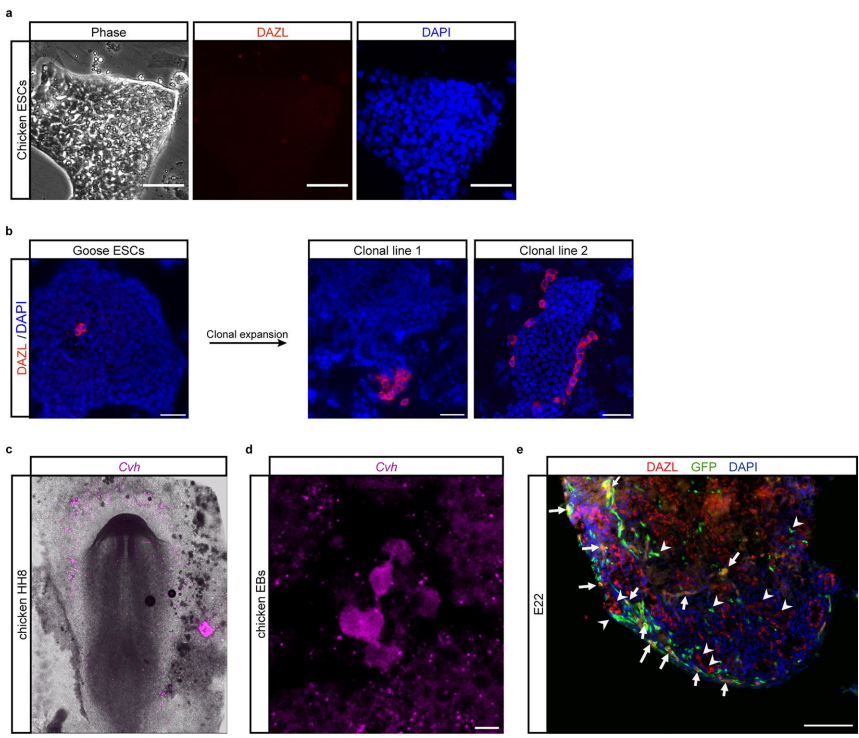
本研究针对禽类缺乏真正种系兼容胚胎干细胞(ES细胞)的技术瓶颈,通过优化培养条件成功建立了鸡及其他七种禽类的ES细胞系。研究人员发现卵转铁蛋白(ovotransferrin)结合Wnt/β-catenin和PKC信号通路抑制剂的OT/2i培养体系可稳定维持鸡ES细胞多能性,进一步通过添加SB431542和鸡白血病抑制因子(chLIF)拓展到其他禽类。研究证实这些ES细胞可高效形成体细胞与种系嵌合体,并能在体外和体内分化为原始生殖细胞(PGCs)。该突破为禽类基因编辑、生物多样性保护及生物技术应用提供了全新平台。论文发表于《Nature Biotechnology》。
 生物通微信公众号
生物通微信公众号
知名企业招聘