
-

生物通官微
陪你抓住生命科技
跳动的脉搏
浆细胞样树突状细胞在系统性及呼吸道病毒感染中的非必需性与有害性作用——基于新型pDC缺失小鼠模型的机制研究
【字体: 大 中 小 】 时间:2025年10月01日 来源:Nature Immunology 27.6
编辑推荐:
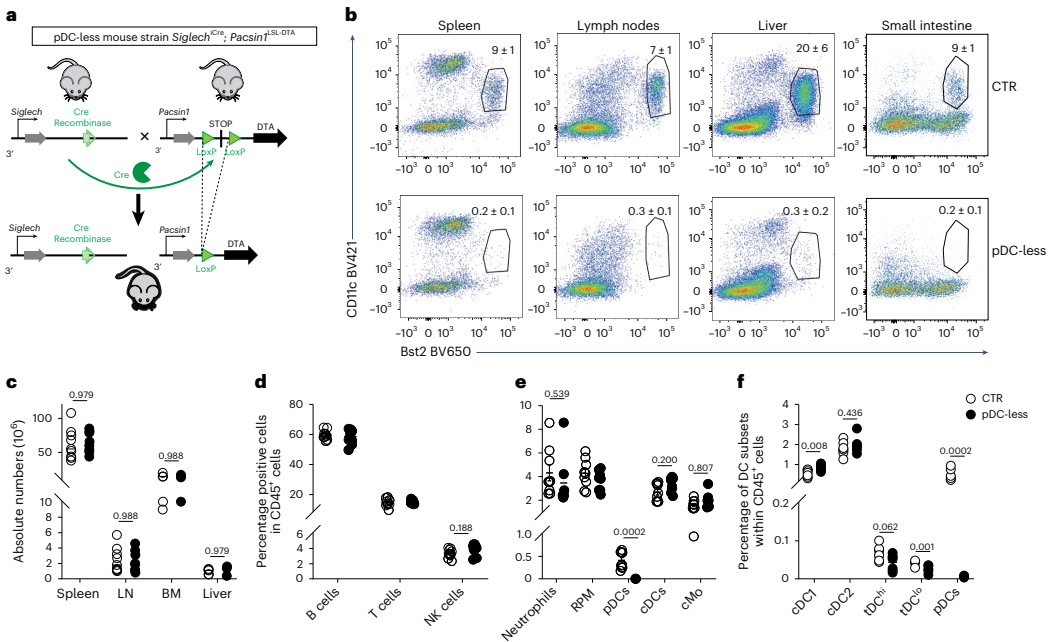
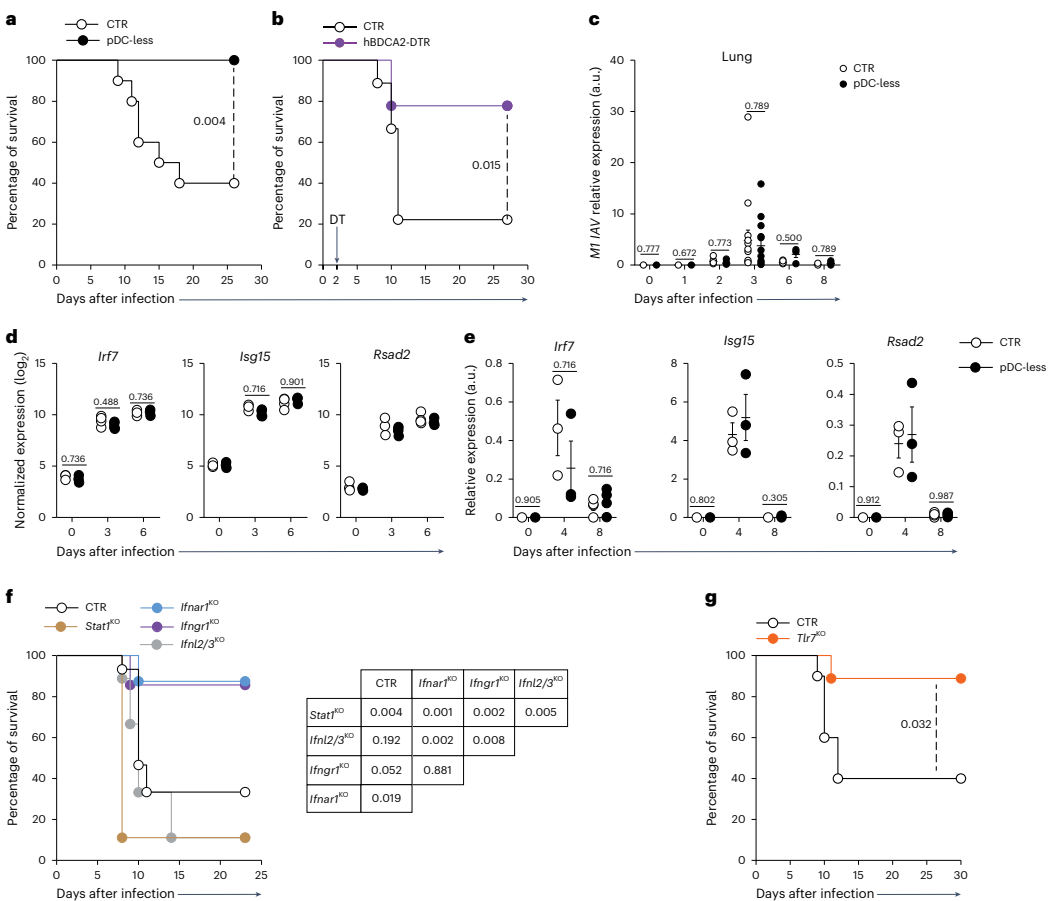
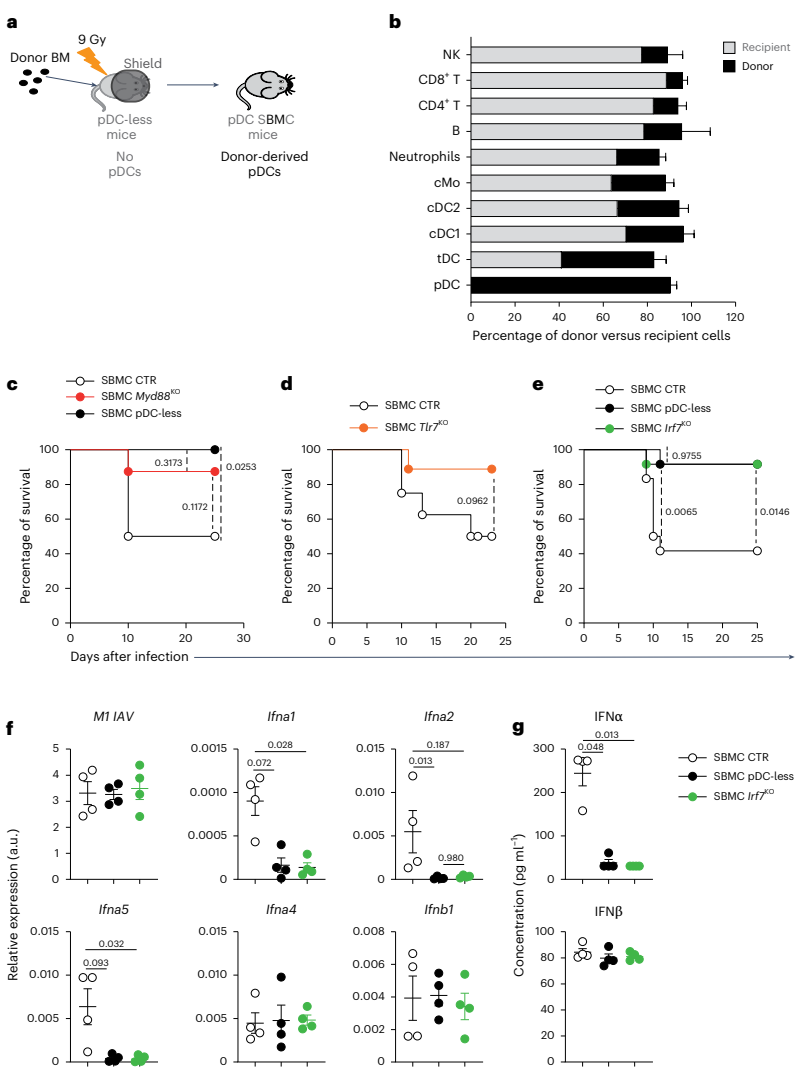
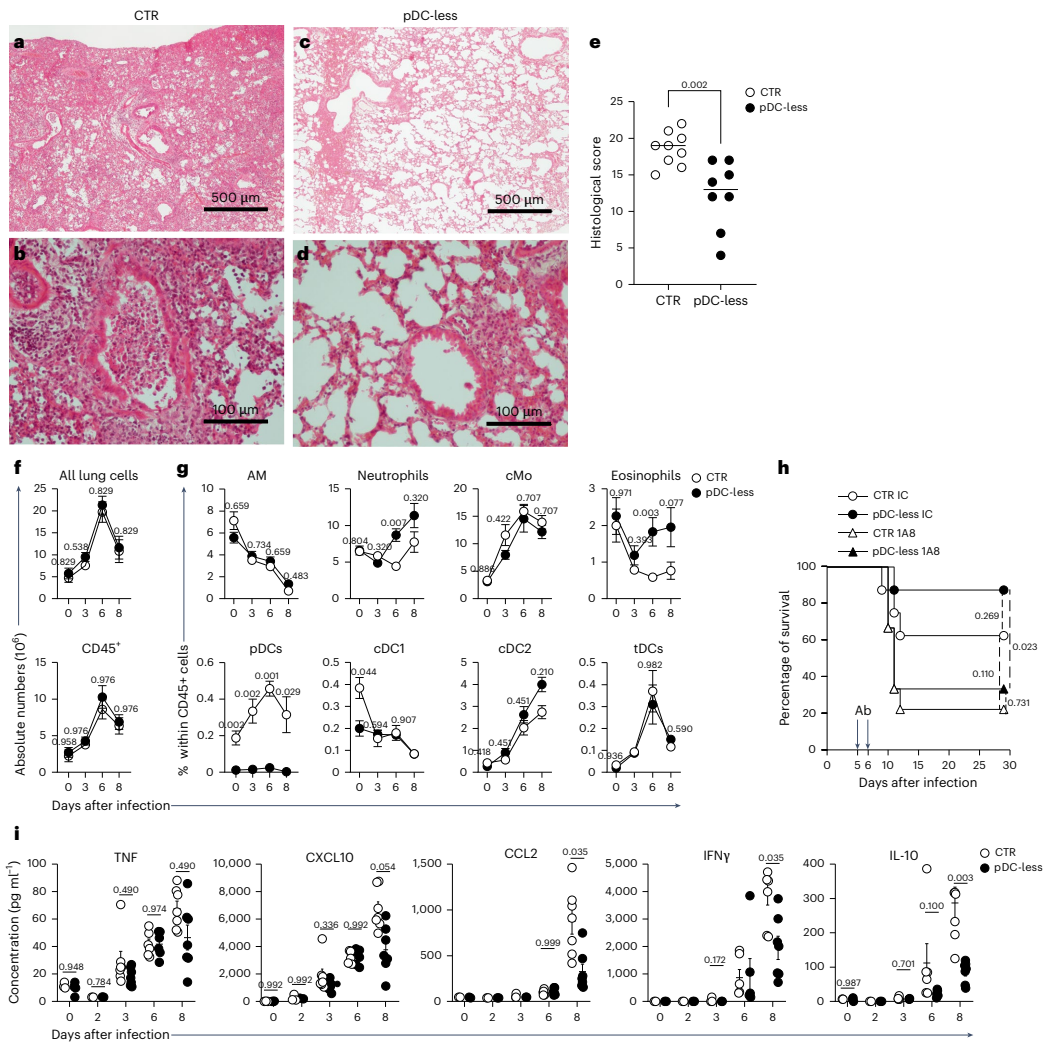
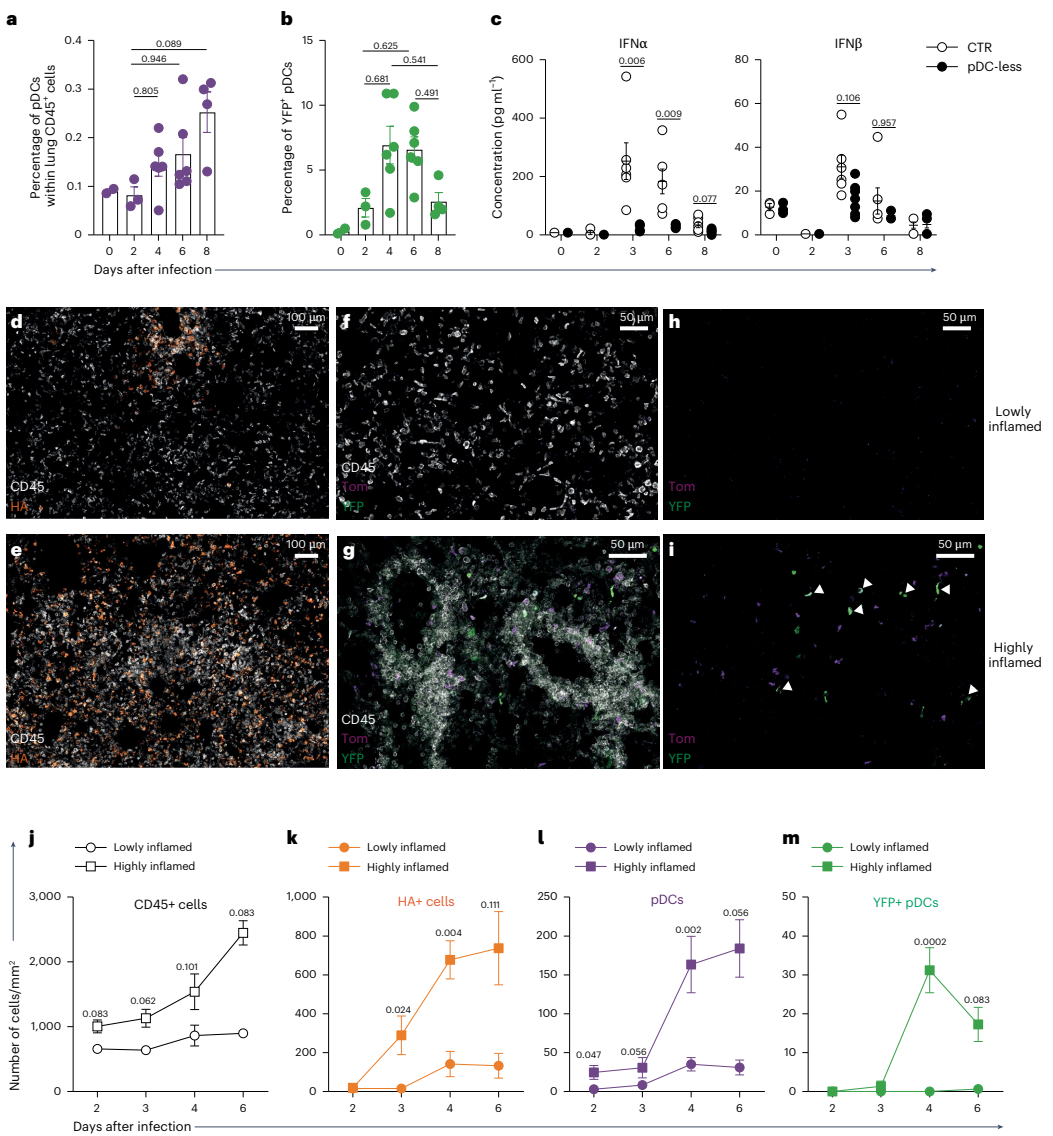
本期推荐:为解决浆细胞样树突状细胞(pDCs)在抗病毒免疫中作用机制的长期争议,研究人员通过构建新型pDC特异性缺失小鼠模型(SiglechiCre×Pacsin1LSL-DTA),发现pDCs在MCMV系统性感染中虽为主要I型干扰素(IFN-I)来源却非必需,而在流感病毒(IAV)和SARS-CoV-2呼吸道感染中反而加剧免疫病理损伤。该研究颠覆了pDCs始终发挥保护作用的传统认知,为靶向干预病毒性肺炎提供了新视角。
 生物通微信公众号
生物通微信公众号
知名企业招聘