
-

生物通官微
陪你抓住生命科技
跳动的脉搏
细胞外基质水凝胶治疗容积性肌肉损失:空间转录组学揭示大动物模型中炎症抑制与再生促进的机制
【字体: 大 中 小 】 时间:2025年10月01日 来源:npj Regenerative Medicine 6.5
编辑推荐:
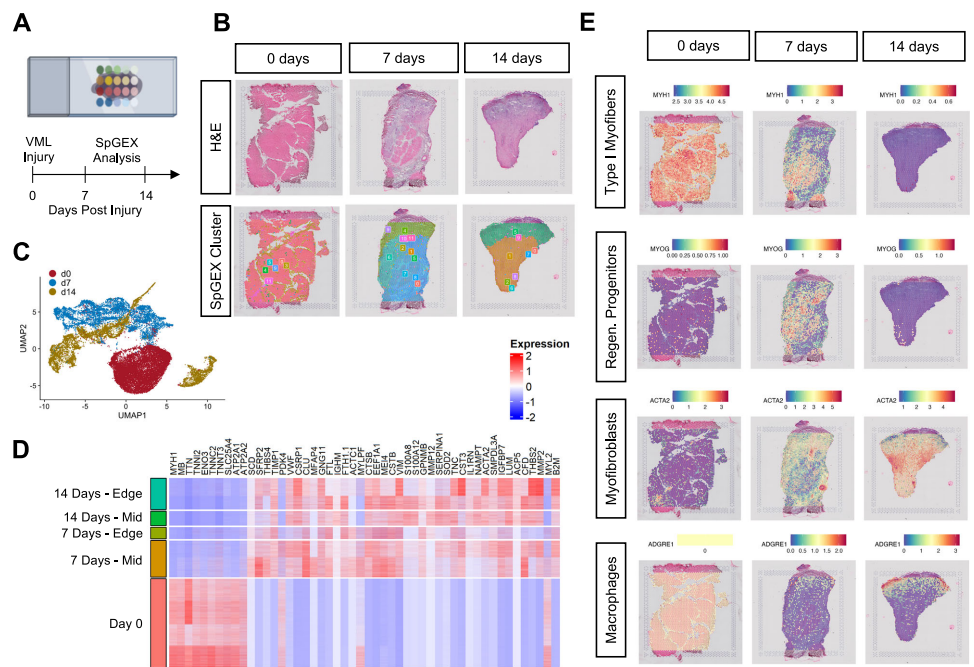
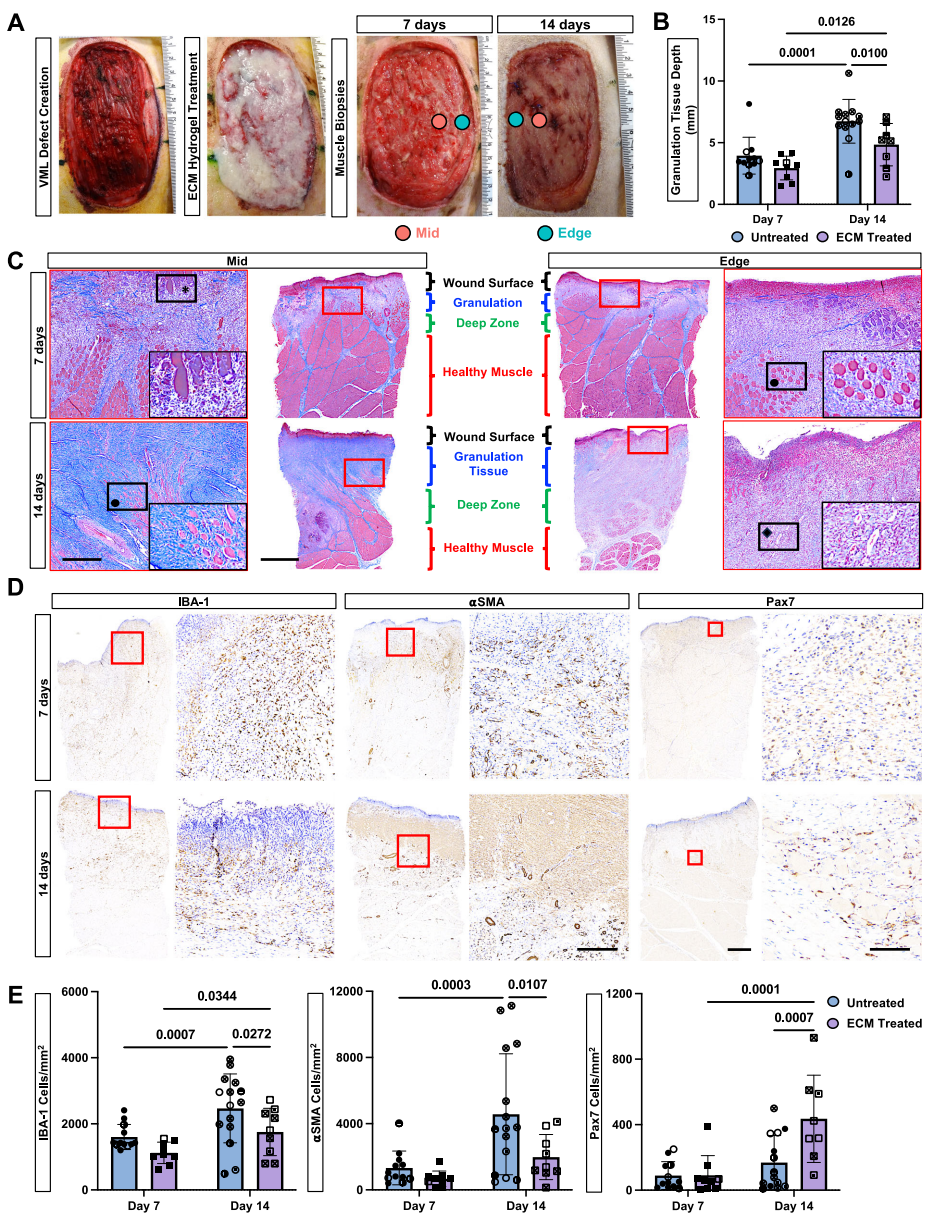
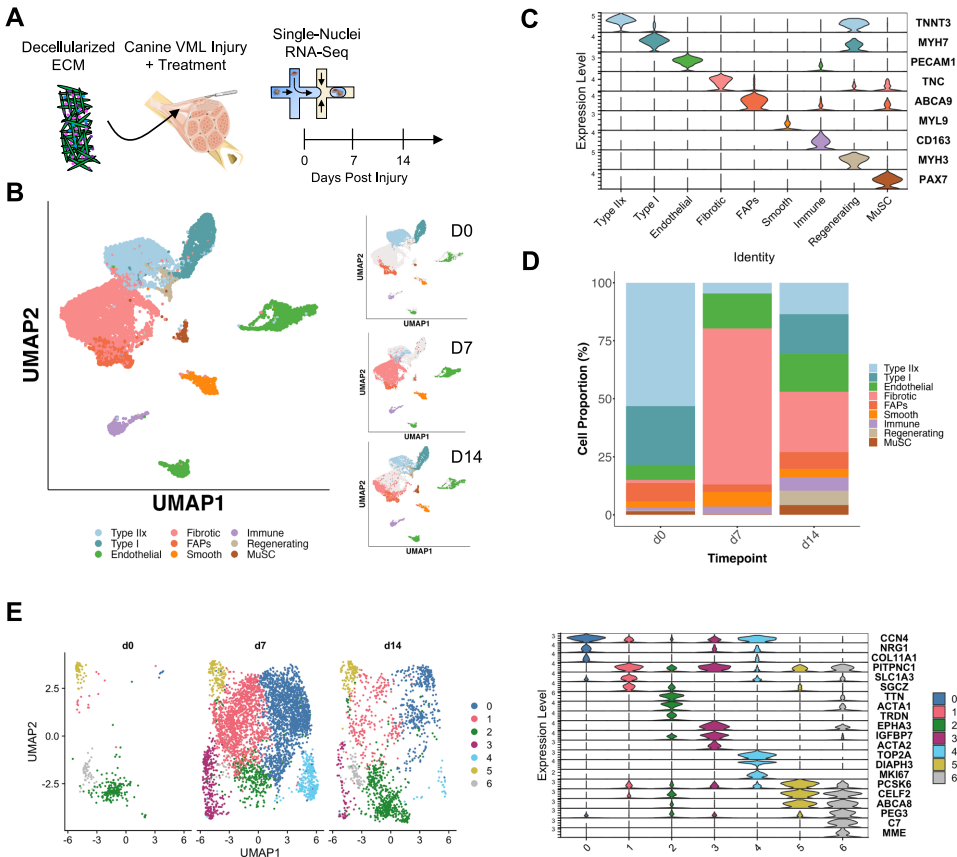
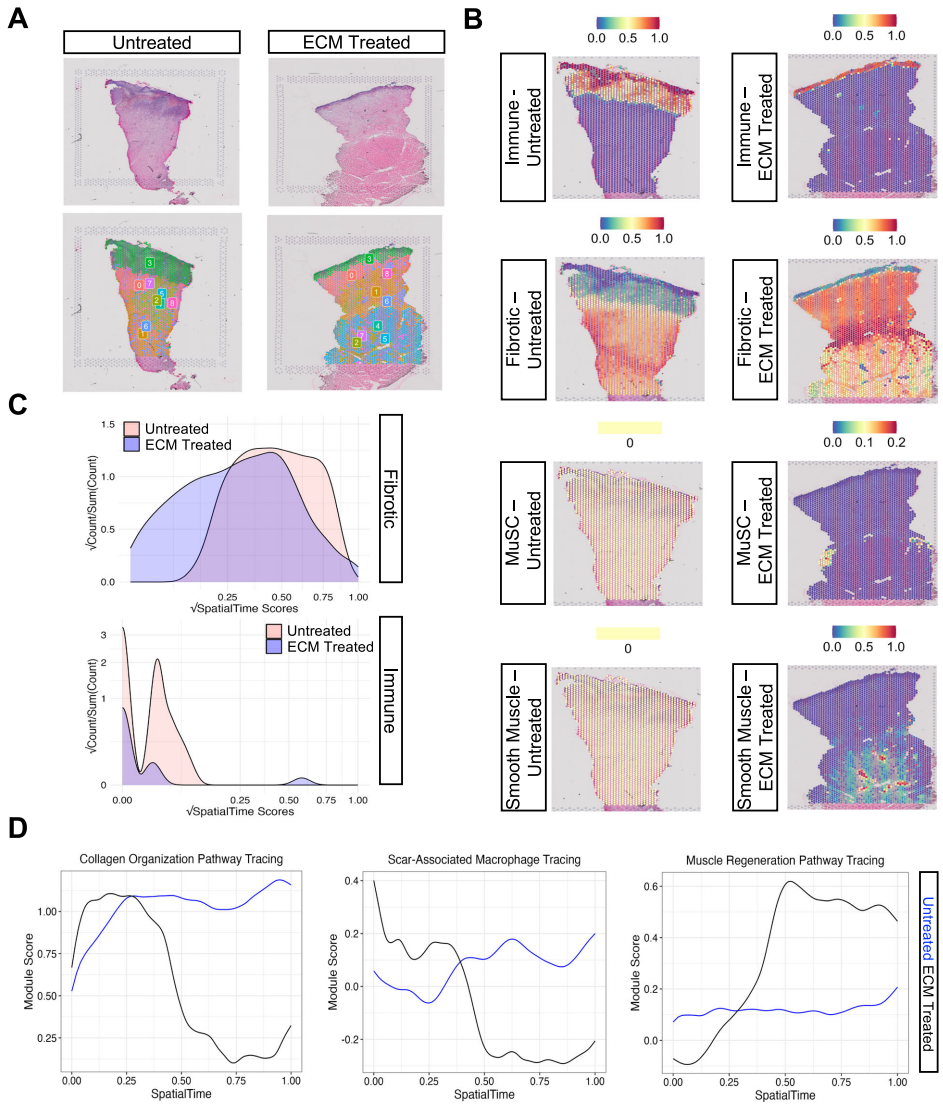
本研究针对容积性肌肉损失(VML)后纤维化瘢痕形成和功能恢复困难的临床难题,通过犬类VML模型结合空间转录组学(spGEX)和单核RNA测序(snRNA-seq)技术,系统解析了细胞外基质(ECM)水凝胶治疗对早期炎症反应、纤维化进程和肌肉再生的调控作用。研究发现ECM治疗通过限制免疫细胞空间分布、促进抗炎型巨噬细胞极化、增加Pax7+肌肉祖细胞浸润,显著改善组织修复微环境。该研究为临床VML治疗提供了重要的时空分子机制依据。
 生物通微信公众号
生物通微信公众号
知名企业招聘