
-

生物通官微
陪你抓住生命科技
跳动的脉搏
靶向LRRC15的放射免疫治疗新策略:重塑肿瘤微环境并克服免疫治疗抵抗
【字体: 大 中 小 】 时间:2025年10月01日 来源:Signal Transduction and Targeted Therapy 52.7
编辑推荐:
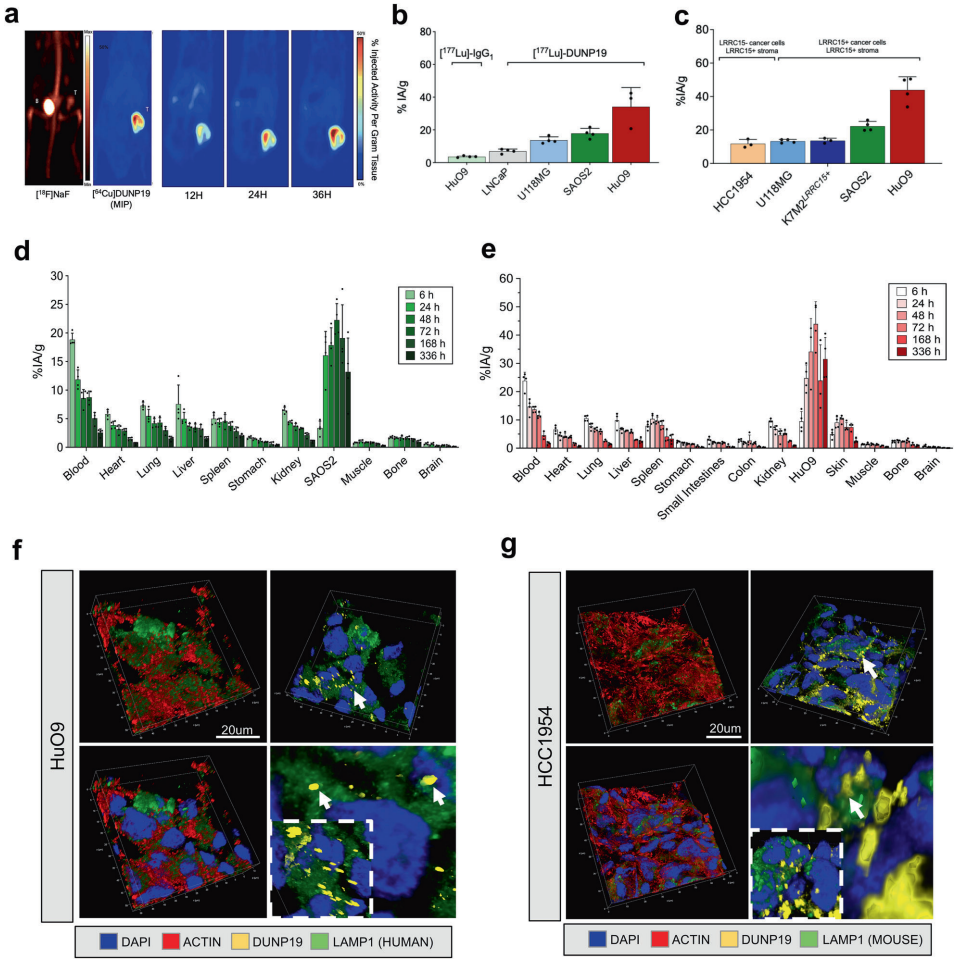
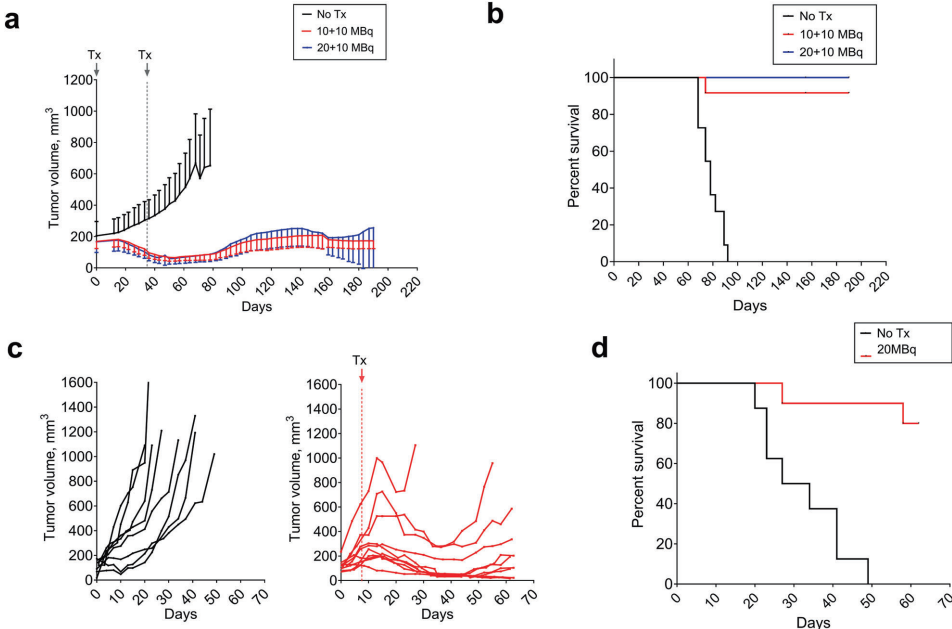
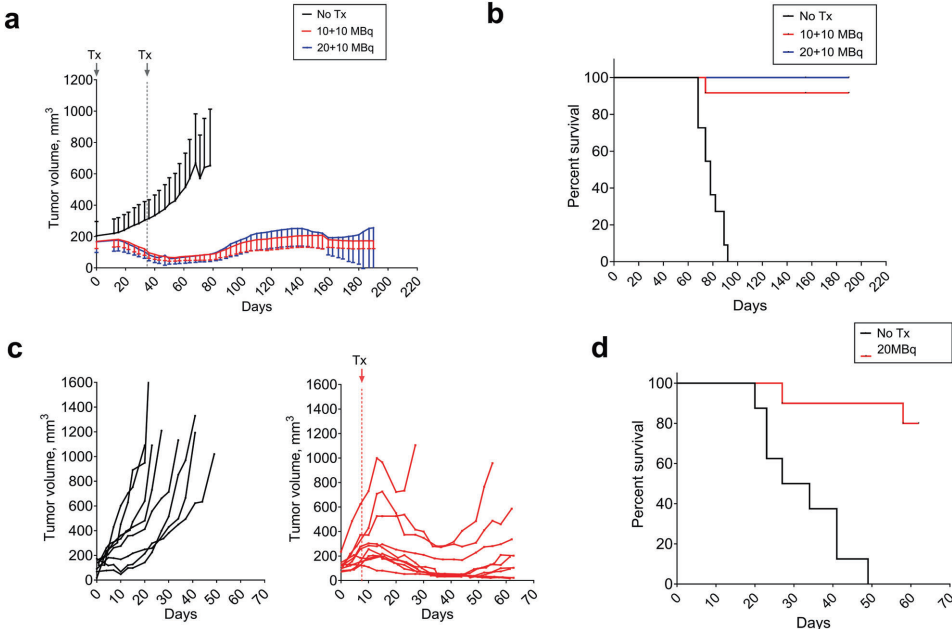
本研究针对LRRC15(富含亮氨酸重复序列蛋白15)这一TGFβ诱导的免疫抑制性生物标志物,开发了一种新型放射免疫治疗抗体DUNP19。通过体内外实验证实,[177Lu]Lu-DUNP19能精准靶向LRRC15阳性肿瘤细胞和癌症相关成纤维细胞(CAFs),有效抑制肿瘤进展并逆转TGFβ驱动的免疫抑制微环境。该研究为治疗耐药性实体瘤提供了集诊断成像与靶向治疗于一体的精准医疗平台,且与免疫检查点抑制剂联用展现显著协同效应。


 生物通微信公众号
生物通微信公众号
知名企业招聘