
-

生物通官微
陪你抓住生命科技
跳动的脉搏
先天性心脏病足月新生儿坏死性小肠结肠炎的早期免疫-微生物群标志物预测模型研究
【字体: 大 中 小 】 时间:2025年10月01日 来源:Scientific Reports 3.9
编辑推荐:
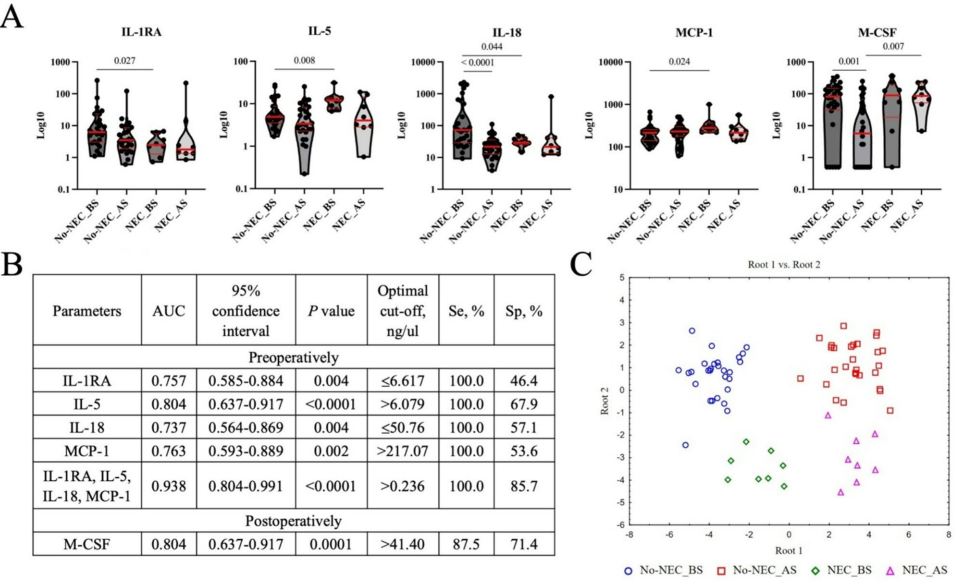
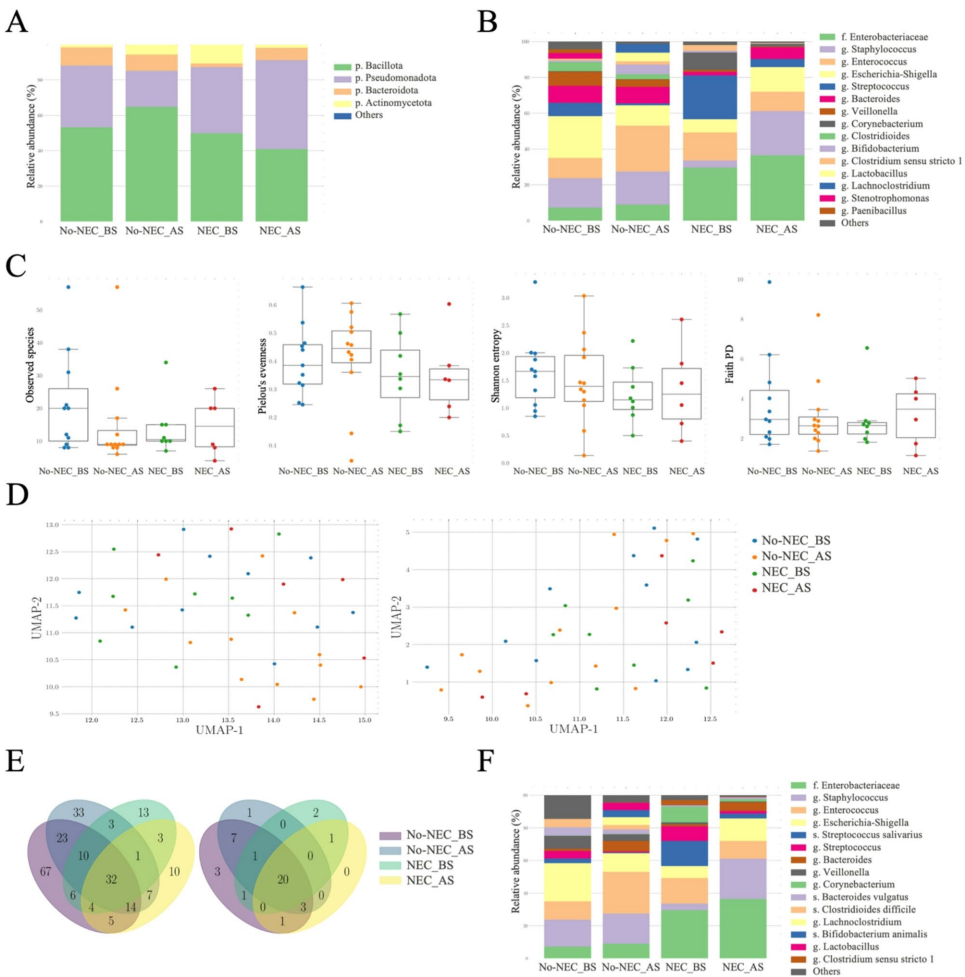
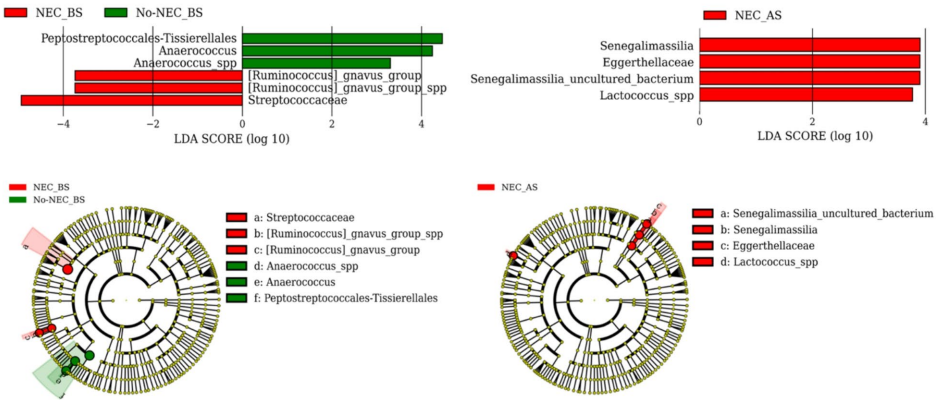
本研究针对先天性心脏病(CHD)足月新生儿坏死性小肠结肠炎(NEC)的早期预测难题,通过分析围手术期细胞因子谱和肠道菌群变化,发现IL-1RA、IL-5、IL-18和MCP-1组成的细胞因子面板可实现NEC的临床前诊断(AUC=0.938),并揭示Collinsella和Mediterraneibacter gnavus等致病菌的富集与NEC发生相关,为新生儿NEC的早期干预提供了新的免疫微生物学依据。

 生物通微信公众号
生物通微信公众号
知名企业招聘