
-

生物通官微
陪你抓住生命科技
跳动的脉搏
GNAS基因突变在儿童病态肥胖中的关键作用及新发现突变的功能验证
【字体: 大 中 小 】 时间:2025年10月02日 来源:Human Genomics 4.3
编辑推荐:
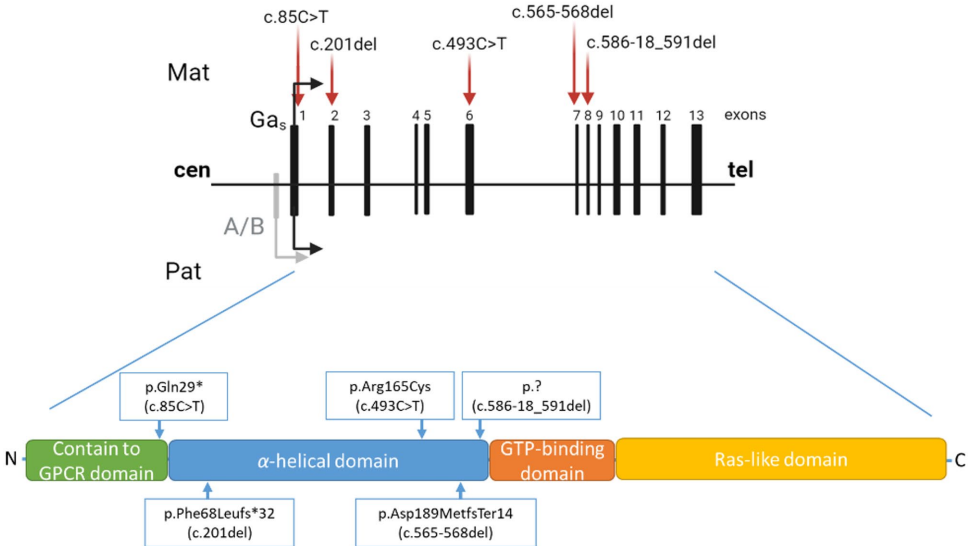
本研究针对儿童早发性病态肥胖的遗传病因诊断难题,通过外显子组测序技术对137例俄罗斯肥胖患儿进行基因筛查。研究人员发现GNAS基因突变占确诊病例的8.9%,其中c.201del(p.Phe68Leufs*32)和c.586-18_591del为首次报道的新突变。研究证实GNAS突变会导致伪甲状旁腺功能减退症(PHP)和Albright遗传性骨营养不良(AHO),并揭示其通过影响黑皮质素受体4型(MC4R)信号通路导致能量代谢紊乱的机制。该研究为儿童病态肥胖的早期分子诊断和精准干预提供了重要依据。

 生物通微信公众号
生物通微信公众号
知名企业招聘