
-

生物通官微
陪你抓住生命科技
跳动的脉搏
尿源Methanobrevibacter smithii U29基因组解析:揭示中细胞变异体的病毒序列整合与泌尿系统适应性进化
《BMC Research Notes》:Methanobrevibacter smithii strain U29 whole genome sequence delineates M. smithii intermediate cell variants
【字体: 大 中 小 】 时间:2025年10月03日 来源:BMC Research Notes 1.7
编辑推荐:
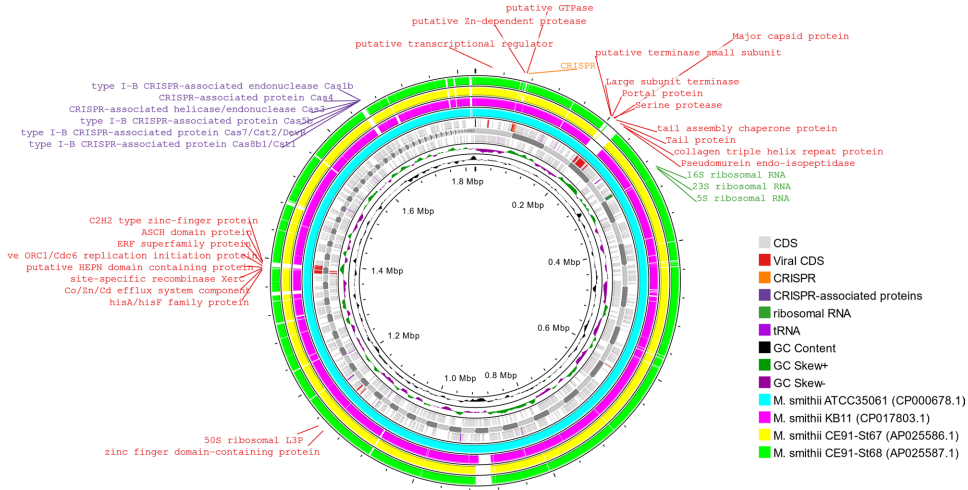
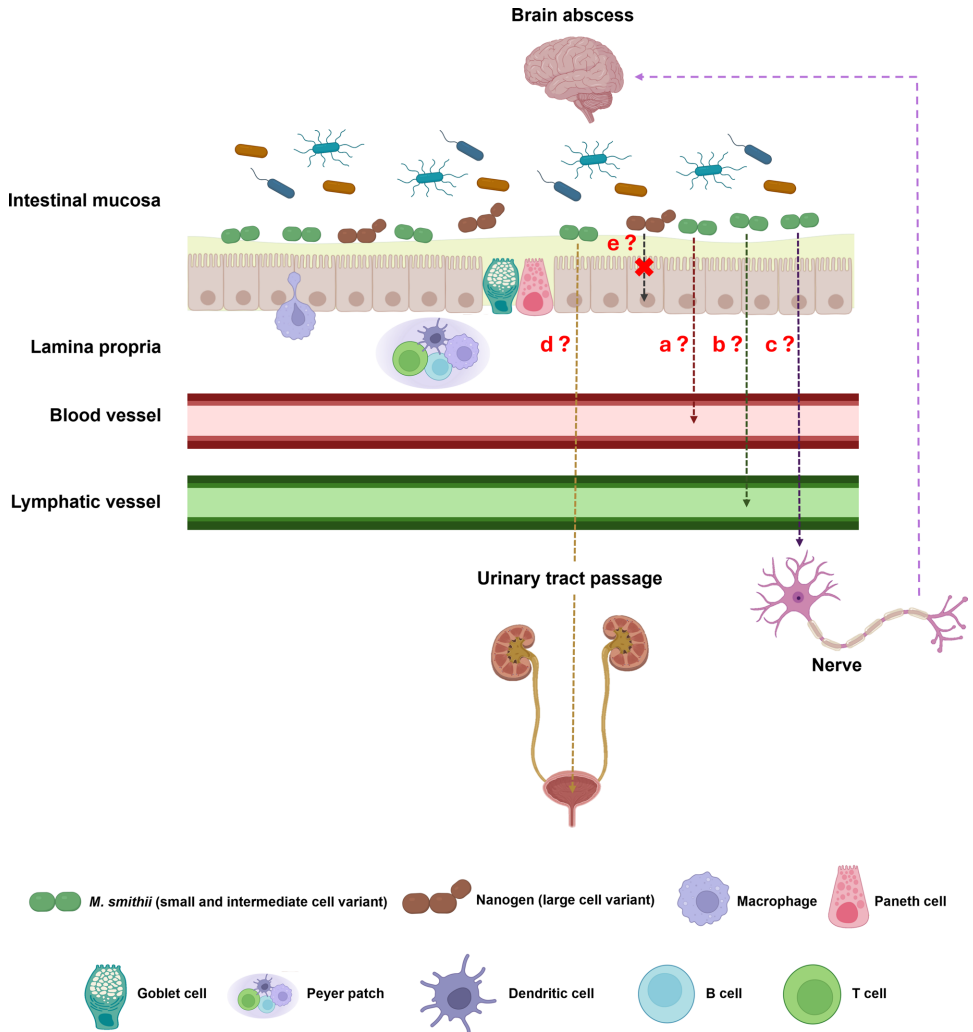
本研究针对泌尿系统中甲烷古菌Methanobacter smithii(M. smithii)基因组多样性缺失的问题,通过完成首例尿液分离株U29的全基因组测序,发现其基因组携带71个独特编码序列(包括12个Siphoviridae病毒来源序列),并鉴定其为中细胞变异体(基因组大小1,822,124 bp)。结果表明,病毒整合可能通过赋予应激耐受与黏附能力促进M. smithii在泌尿道的定植,为阐释古菌跨组织 translocation 机制及病毒-宿主共进化提供了新视角。

 生物通微信公众号
生物通微信公众号
知名企业招聘